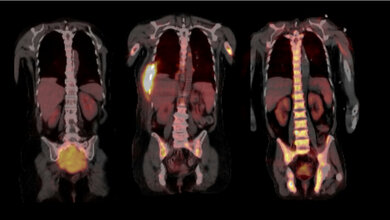
Das Multiple Myelom ist eine Krebserkrankung, bei der Immunzellen des Knochenmarks, sogenannte Plasmazellen, entarten. Plasmazellen sind für die Produktion von Antikörpern verantwortlich. Jeder Mensch verfügt über eine Vielzahl unterschiedlicher Plasmazellen, die unterschiedliche Antikörper in großer Zahl bilden. So kann der Körper verschiedene Krankheitserreger erkennen und bekämpfen. Im Fall des Multiplen Myeloms entwickelt sich eine einzelne Plasmazelle zur Tumorzelle. Sie vermehrt sich ungehemmt und bildet eine monoklonale Zellpopulation, das heißt, es entstehen viele Zellen, die alle exakt gleich und zunächst genetisch identisch sind. Auch sie produzieren oft Antikörper in großer Zahl oder Bruchstücke von ihnen – jedoch sind diese funktionslos. Die Erkrankung trat laut Zentrum für Krebsregisterdaten im Jahre 2020 in Deutschland bei etwa 3.010 Frauen und 3.700 Männern neu auf. Das Erkrankungsrisiko steige in höherem Alter deutlich an, Erkrankungen vor dem 45. Lebensjahr seien äußerst selten. Die Prognose sei jedoch eher ungünstig mit relativen 5-Jahres-Überlebensraten von 58 Prozent bei Frauen sowie 56 Prozent bei Männern.
Bisher keine Heilung
Im Verlauf der Krankheit entstehen meist mehrere Tumorherde an vielen Stellen des Knochenmarks. Immunschwäche, Nierenversagen, Knochenabbau und Knochenbrüche sind nur einige der Folgen des unkontrollierten Zellwachstums. Trotz therapeutischer Fortschritte und der Einführung neuer zellulärer Immuntherapien gibt es für das Multiple Myelom heute noch keine Heilung. Ein Forschungsteam um Prof. Jan Krönke, Medizinische Klinik mit Schwerpunkt Hämatologie, Onkologie und Tumorimmunologie der Charité – Universitätsmedizin Berlin, und Dr. Philipp Mertins, Leiter der Technologieplattform Proteomik von Max Delbrück Center und Berlin Institute of Heath in der Charité (BIH), hat sich daher auf die Suche nach neuen diagnostischen und therapeutischen Ansätzen begeben.
Was macht Verläufe so unterschiedlich?
Jede Krebserkrankung ist anders, so auch beim Multiplen Myelom. Tumorherde entwickeln sich individuell verschieden und mit unterschiedlicher Geschwindigkeit. Das erschwert eine Einschätzung des Krankheitsverlaufs und die Wahl der optimalen Behandlung. Während sich veränderte Plasmazellen manchmal nur wenig verbreiten, verhalten sie sich in anderen Fällen äußerst aggressiv, was mit einer schlechten Perspektive für den weiteren Krankheitsverlauf einhergeht. Was also macht die Verläufe bei Multiplem Myelom so unterschiedlich? Gemeinsam mit Experten für Proteinanalysen des Max Delbrück Center und des BIH haben die Forschenden genetische und molekulare Veränderungen in den Tumorzellen bei einer Gruppe von mehr als einhundert Erkrankten im Detail untersucht. Eingeflossen sind Daten von Patienten der Deutschen Studiengruppe Multiples Myelom (DSMM), die am Universitätsklinikum Würzburg koordiniert wird. Die Forschenden konnten somit auch klinische Daten von einheitlich behandelten Patienten über einen Zeitraum von acht Jahren und länger nach der Erstdiagnose einbeziehen.
Erste umfangreiche proteogenomische Studie
Während für andere Krebsarten die Veränderungen im Genom und ihre Auswirkungen auf das Proteom bereits gut beschrieben sind, sei dies die erste umfangreiche proteogenomische Studie für das Multiple Myelom. „Um die Krankheitsmechanismen aufzuklären, reichen Daten zur Genetik allein nicht aus“, sagt Dr. Mertins. „Wir wollten wissen, welche Folgen genetische Veränderungen auf der Ebene der Proteine haben und diese molekularbiologischen Daten mit dem tatsächlichen Verlauf bei den Patientinnen und Patienten abgleichen.“ Bei der Erhebung und Auswertung der umfangreichen Datenmengen hatte das Team Unterstützung durch Experten an Charité, BIH und des Deutschen Konsortiums für Translationale Krebsforschung (DKTK).
Einsatz neuester massenspektrometrischer Methoden
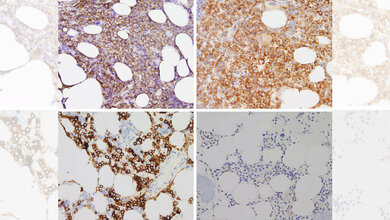
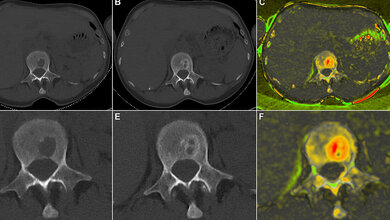
Neueste massenspektrometrische Methoden ermöglichten es, das Proteinprofil entarteter Plasmazellen zu erstellen und mit dem Profil gesunder Plasmazellen von nicht erkrankten Personen zu vergleichen. Das Ergebnis: Sowohl genetische Veränderungen als auch Veränderungen in den Signalwegen führen zu einer unkontrollierten Aktivierung der Krebszellen. Regulatorische Prozesse auf der Proteinebene hatten dabei den stärkeren Einfluss. Die Forschenden konnten eine Proteinkonstellation ausfindig machen, die unabhängig von bekannten Risikofaktoren auf einen besonders aggressiven Krankheitsverlauf hinweist.
Therapie künftig personalisieren?
„Die Erkenntnisse werden dazu beitragen, Patientinnen und Patienten künftig besser in Untergruppen einzuteilen und damit die Therapie zu personalisieren“, folgert Prof. Krönke. „Wir haben wichtige Proteine und Signalwege identifiziert, die Grundlage für noch wirksamere und verträglichere Therapien für das Multiple Myelom sein können, zum Beispiel für Immuntherapien wie die CAR-T-Zell-Therapie.“ Welche der gefundenen Zielstrukturen für neue therapeutische Ansätze tatsächlich infrage kommen, werden die Wissenschaftler/-innen in weiteren Schritten untersuchen.
Für die Forschung und die anwendungsbezogene Entwicklung sei die Studie eine zentrale Ressource, betont Dr. Evelyn Ramberger, Erstautorin der Studie: „Um den komplexen Datensatz handhabbar zu machen, haben wir ein interaktives und frei verfügbares Online-Tool programmiert.“ Damit sollen Krebsforscher/-innen einen einfachen Zugang zu den Ergebnissen haben und die Informationen für die Entwicklung neuer Therapien und Tests zur Therapiesteuerung nutzen können. So könnten Patienten mit einer besonders aggressiven Form des Multiplen Myeloms möglicherweise gleich zu Beginn mit einer intensiveren Therapie behandelt werden.
Quelle: idw/Charité
Artikel teilen