Hinter einen neuen molekularen Mechanismus, der die Herzmuskelerkrankung hypertrophe Kardiomyopathie (HCM) verursacht, sind Forscher vom Universitätsklinikum Hamburg-Eppendorf (UKE) gekommen. Der Mediziner Dr. Marc D. Lemoine, Klinik für Kardiologie mit Schwerpunkt Elektrophysiologie, Universitäres Herz- und Gefäßzentrum, und der Biologe Dr. Maksymilian Prondzynski, Institut für experimentelle Pharmakologie und Toxikologie, haben dafür jetzt den mit 5.000 Euro dotierten Wilhelm P. Winterstein-Preis der Deutschen Herzstiftung (www.herzstiftung.de) erhalten.
Individualisierte Therapie bei genetischen Herzerkrankungen
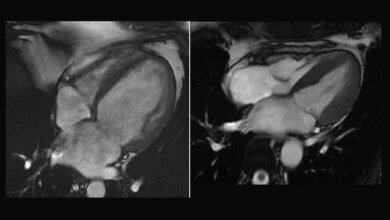
Das Hamburger Duo hat mit seiner Arbeit gezeigt, wie eine individualisierte Therapie bei genetischen Herzerkrankungen ermittelt werden kann. Über 160.000 Menschen leiden in Deutschland an der HCM. Damit handelt es sich um die häufigste erbliche Herzerkrankung. Hauptmerkmal ist eine verdickte Wand der linken Herzkammer. Im Laufe der Erkrankung kann die HCM zu Luftnot und Herzrhythmusstörungen führen, schlimmstenfalls sogar zum plötzlichen Herztod. „Nur mit Hilfe wirkungsvoller Behandlungsmethoden lassen sich die bedrohlichen Folgen der HCM verhindern. Passgenaue Therapieansätze zur gezielten Bekämpfung der HCM sind daher dringend notwendig“, betont Prof. Dr. med. Dietrich Andresen, Vorstandsvorsitzender der Deutschen Herzstiftung. „Mit ihrer prämierten Arbeit sind die beiden Forscher den Ursachen der HCM auf die Spur gekommen – eine vielversprechende Basis für neue Behandlungsstrategien gegen die HCM.“
Entdeckung per Zufall bei Patientenuntersuchung
Es begann mit einem Zufall. „In unserer Spezialambulanz für HCM fanden wir beim Genscreening einer Patientin eine bislang unbekannte Genmutation“, erklärt Dr. Lemoine. Insgesamt sind auf 27 verschiedenen Genen 1.500 Gendefekte registriert, die die HCM auslösen können. So war das Gen namens „ACTN2“ den Medizinern bekannt. Es enthält Informationen zur Herstellung eines Proteins, das für die Zellstruktur verantwortlich ist. Den Defekt jedoch kannten sie nicht. Den wollten Dr. Lemoine und Dr. Prondzynski nun genauer betrachten. Sie entnahmen der besagten Patientin Hautzellen und programmierten diese mithilfe gentechnischer Kniffe in so genannte induzierte pluripotente Stammzellen (iPS) um. Aus diesen Zellen kann man jeden Zelltyp züchten. Die beiden Forscher schufen daraus Herzzellen. Sie trugen alle den Gendefekt, denn der vererbt sich von Zelle zu Zelle weiter.
Untersuchung am künstlichen Laborherz
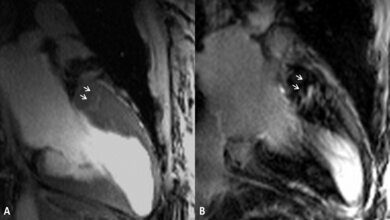
Um die Funktion dieses Gendefekts besser charakterisieren zu können, stellten die Wissenschaftler aus Millionen dieser Herzzellen ein künstliches Herzgewebe her. „Es kontrahiert wie ein richtiges Herz und zieht sich auf elektrische Reize hin zusammen“, sagt Dr. Prondzynski. Ein Zentimeter lang und ein, zwei Millimeter dick war das an HCM erkrankte Laborherz der Forscher, das an Silikonstreifen befestigt in Zellflüssigkeit hing. Um die kranken Herzzellen mit einer gesunden Kontrolle vergleichen zu können, korrigierten die Forscher mithilfe der Genschere (CRISPR/CAS9) die Mutation in den Stammzellen. „So hatten wir gesunde Ausgangszellen, wie von einem gesunden Zwilling“, erklärt Dr. Prondzynski. So entstanden ein krankes und ein gesundes Laborherz für ihre Untersuchungen.
Gefahr für Extraschläge erhöht
Das Ergebnis: Die Kontraktionen der kranken Herzzellen waren stärker und dauerten länger als bei den gesunden. Die elektrische Erregung war deutlich in die Länge gezogen. Als zugrunde liegenden Mechanismus vermuten die Wissenschaftler, dass der winzig kleine neu erkannte Gendefekt bewirkt, dass das für die Zellstruktur verantwortliche Protein fehlerhaft ist und seine Funktion nicht richtig ausüben kann. Das hat dann wiederum zur Folge, dass vermehrt Kalziumionen in die Herzzellen einströmen und die elektrische Erregungsleitung und Kontraktionszeit verlängern. Damit erhöht sich die Gefahr für Extraschläge. „Dies könnte ein Grund für Herzrhythmusstörungen bei HCM-Betroffenen sein“, so Dr. Lemoine.
Passgenaue Arznei am Patienten erprobt
Wichtig ist den Hamburger Forschern ihr translationaler Ansatz. Das bedeutet, salopp gesagt, dass ihre Arbeit vom Patienten in die Petrischale und dann zurück zum Patienten führt. In einem nächsten Schritt testeten Dr. Lemoine und Dr. Prondzynski, wie das kranke Laborherz auf Diltiazem reagiert, ein Arzneistoff, das den Kalziumstrom bremst. Dies hatte Erfolg. „Sie hatten Werte wie gesunde Zellen“, betont Dr. Prondzynski. Die behandelnden Ärzte verabreichten im weiteren Schritt den von HCM betroffenen Familienmitgliedern Diltiazem. Ihre EKGs normalisierten sich. Sie haben dank der Forschung der beiden Mediziner mit iPS-Zellen die für sie passgenaue Arznei erhalten.
Weitere Informationen
Der Wilhelm P. Winterstein-Preis wird alljährlich für eine wissenschaftlich herausragende Arbeit auf dem Gebiet der Herz-Kreislauf-Erkrankungen, bevorzugt aus einem patientennahen Forschungsbereich, vergeben. 2019 hat die Stifterin Ursula Winterstein den Preis ihres 2018 verstorbenen Ehemannes für zwei ausgezeichnete Forschungsprojekte vergeben. Neben Dr. Lemoine und Dr. Prondzynski wurde auch Dr. med. Timon Seeger vom Universitätsklinikum Heidelberg mit diesem Wissenschaftspreis ausgezeichnet. (idw, red)
Ein Video-Clip mit einem Strang künstlichen Herzgewebes („Laborherz“) (Länge: ca. 7 mm) gibt es hier (Quelle: UKE).
Prondzynski M., Lemoine M. et al. Disease modeling reveals causative role for an α-actinin 2 mutation and a diltiazem-reversible long QT phenotype in hypertrophic cardiomyopathy – an example of personalized medicine.
Artikel teilen