Tbc: Personalisierte Antibiotika-Behandlungsstrategien
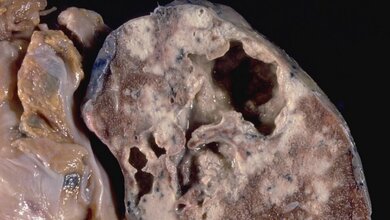
Nach den Schätzungen der Weltgesundheitsorganisation (WHO) erkranken jedes Jahr etwa 10 Millionen Menschen an einer Tuberkulose und etwa 1,5 Millionen Menschen sterben daran (Angaben für 2020). Neben einer HIV/Tbc-Koinfektion stellen resistente und multiresistente (MDR) Varianten des Tuberkuloseerregers Mycobacterium tuberculosis eine große Gefahr für die Kontrolle der Tuberkulose und die globale Gesundheit dar. Um Erkrankte zielgerichtet behandeln und die Übertragung von Antibiotika-resistenten Tuberkulosebakterien erfolgreich eindämmen zu können, ist die rasche Erkennung dieser patientenspezifischen Resistenzmuster daher von entscheidender Bedeutung. Diesem Ziel sind DZIF-Wissenschaftler/-innen nun einen großen Schritt nähergekommen.
Mutationen in unterschiedlichen Kombinationen
Mutationen im Erbgut von multiresistenten (MDR) M. tuberculosis-Bakterien kommen bei MDR-Tuberkulose-Patientinnen und Patienten in unterschiedlichen Kombinationen vor. In einer vorgestellten internationalen Studie gelang es DZIF-Forscherinnen und -Forschern nun, mithilfe einer bakteriellen Genomanalysetechnik patientenspezifische Resistenzmuster zu erkennen. Die Bestimmung dieser Resistenzmuster könnte zukünftig als Grundlage für die gezielte personalisierte Behandlung Tuberkulose-Erkrankter dienen.
Vorhersage über Antibiotikawirksamkeit
In der multizentrischen Beobachtungsstudie sequenzierten DZIF-Wissenschaftler/-innen des Forschungszentrums Borstel und des Uniklinikums Heidelberg die Genome einer großen Anzahl klinischer M. tuberculosis-Isolate aus der ganzen Welt. Dabei fanden die Forscherinnen und Forscher, dass bestimmte Veränderungen (Mutationen) im Bakterien-Genom mit der Wirksamkeit von Antibiotika bei den betreffenden Tuberkulose-Erkrankten eng korrelierten. Die Identifizierung bestimmter Mutationen im Bakterien-Genom ermöglicht daher potenziell eine Vorhersage darüber, welche Antibiotika bei einem Patienten noch wirken, beziehungsweise, ob die Dosis erhöht werden sollte. Mit diesem Wissen lasse sich der Erfolg der initialen Antibiotikatherapie steigern und die weitere Übertragung des Erregers verhindern.
Besser als Bakterienkultur-basierende Resistenztestung?
„Diese großangelegte Studie ist das Resultat einer engen Zusammenarbeit zwischen DZIF-Wissenschaftler/-innen in Borstel und Heidelberg, der globalen Diagnostik Allianz FIND, und Partnern in fünf Ländern, in denen Tuberkulose hochgradig endemisch ist. Die Sequenz-Analyse ermöglicht uns ein besseres Verständnis der genetischen Grundlagen für Resistenzen gegen Tuberkulosemedikamente und deshalb eine schnellere, personalisierte Tuberkulose-Behandlung“, resümiert PD Dr. Claudia Denkinger, Letztautorin der Publikation.
„Wir haben in der vergleichenden Genomanalyse zum Beispiel auch Veränderungen im Erbgut der Bakterien beobachtet, die nicht immer zu eindeutigen Ergebnissen bei der klassischen – auf Bakterienkulturen-basierenden – Resistenztestung führen, aber möglicherweise die Therapie beeinflussen können“, sagt Dr. Matthias Merker, einer der Erstautoren der Studie und Schleswig-Holstein Excellence-Chair Nachwuchsgruppenleiter am Forschungszentrum Borstel.
Langwierige Tests ersetzbar?
„Unsere Studie zeigt auch, dass die Erbgutanalyse der Bakterien bereits eine präzise Vorhersage von Resistenzen gegen wichtige Tuberkulose-Antibiotika ermöglicht und viele der klassischen und oft langwierigen Tests ersetzen kann“, fügt Prof. Stefan Niemann vom Nationalen Referenzzentrum für Mykobakterien in Borstel, einer der Letztautoren der Studie, an. „In Zukunft wollen wir diese bakterielle Genomanalysetechnik speziell in den Tuberkulose-Schwerpunkten im südlichen Afrika, Osteuropa und Zentralasien weiter ausbauen“.
Quelle: DZIF
Artikel teilen