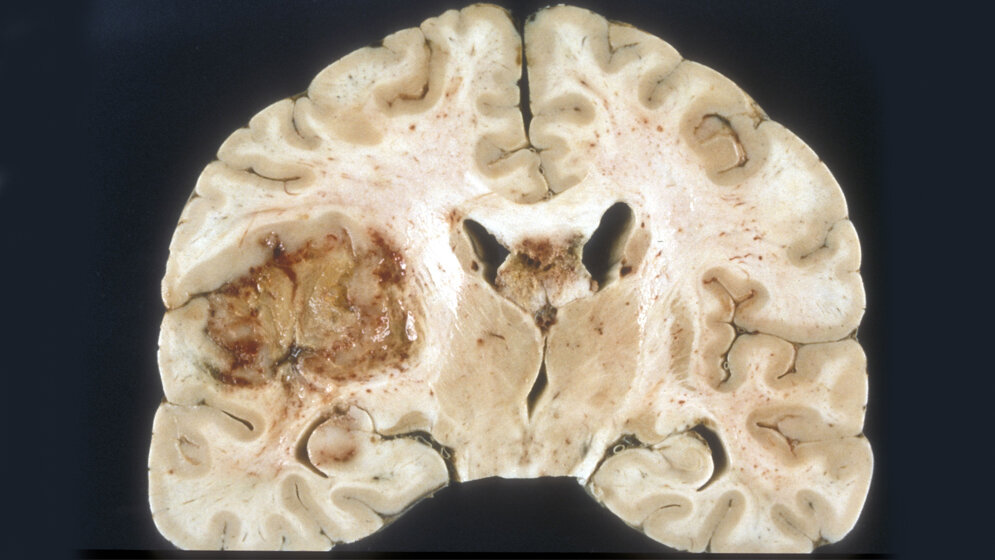
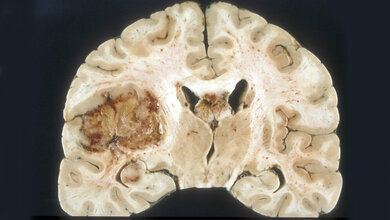
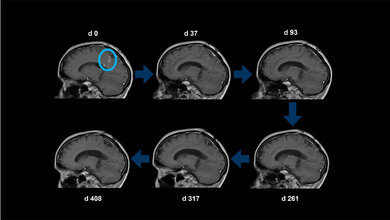
Das Glioblastom ist der häufigste und zugleich bösartigste Hirntumor, an dem allein in Deutschland jährlich etwa 4.000 Menschen erkranken. „Etwa die Hälfte der Patienten überleben von der Diagnose an nur durchschnittlich 16 Monate“, sagt Prof. Dr. Rainer Glaß von der Neurochirurgischen Klinik und Poliklinik des LMU Klinikums Großhadern: „eine klinisch sehr unbefriedigende Situation.“ Zum einen wachsen die entarteten Zellen unglaublich aggressiv. Zum anderen bleiben die üblichen Waffen der Medizin im Kampf gegen den Krebs – Chirurgie, Strahlen- und Chemotherapie sowie „zielgerichtete“ Therapie mit Medikamenten – weitgehend stumpf. Neue Behandlungsformen sind mithin dringend nötig.
Zellen vom Krebs „manipuliert“
In diesem Bereich brauche es innovative Forschung. Die Tumorzellen des Glioblastoms sind eingebettet in eine Nachbarschaft gesunder Zellen (Parenchym). Allerdings werden viele dieser Zellen vom Krebs manipuliert. Beispiel: Makrophagen – die „Fresszellen“ des Immunsystems – sollten den Tumor eigentlich bekämpfen. Stattdessen sind sie so „umprogrammiert“, dass sie das Wachstum des Glioblastoms beschleunigen. Ein entscheidender Faktor für den Krebs, denn immerhin machen diese Makrophagen 30 Prozent der Zellmasse im Parenchym aus.
TAMEP haben wichtige Aufgaben
Rainer Glaß und seine Kollegen haben nun Zellen in diesem Tumormilieu gefunden, die bei oberflächlicher Betrachtung zunächst wie gewöhnliche Fresszellen aussahen. Doch als die Forscher des LMU Klinikums die Zellen genauer analysierten, befanden sie sich plötzlich mitten in einer Expedition in unbekanntes Gebiet. Mit einem Arsenal an High-Tech-Hilfsmitteln – genetisch veränderte Mäuse, „intravitale“ Bildgebung, Einzelzell-Transkription, Immunfluoreszenzanalyse und Histopathologie – stellte sich heraus:
- Die Zellen lassen sich klar von Makrophagen abgrenzen, denn sie stammen nicht von den gleichen „myeoliden“ Stammzellen ab, sondern sind bisher noch unbekannten Ursprungs.
- Diese TAMEP genannten Zellen sind stark am aggressiven Wachstum des Glioblastoms beteiligt. Sie fördern offenbar an entscheidender Stelle die Bildung neuer Blutgefäße, die der „gefräßige“ Tumor braucht, um seine immer neuen Zellen zu füttern und rasant zu wachsen. Über die Blutbahnen werden Nährstoffe herangeschafft.
- Als die Forscher die Funktion der TAMEP ausschalteten, hemmte dies auch das Wachstum des Glioblastoms, und zwar um 60 bis 70 Prozent. Sie haben ganz wichtige Aufgaben im Tumorwachstum und sind auch nur dort und sonst nirgends im Gehirn zu finden.
Eine Entdeckung mit therapeutischer Bedeutung
„Der Tumor schrumpfte zwar nicht vollständig“, sagt Rainer Glaß, „aber er kam über eine bestimmte Größe nicht mehr hinaus.“ Der Wissenschaftler betont denn auch die therapeutische Bedeutung bei aggressiven Hirntumoren. Denn schon haben die Forscher begonnen, die Signalwege zu entschlüsseln, mit denen die TAMEP ihre verhängnisvolle Funktion umsetzen. Das Ziel: Ansatzpunkte im molekularen Geschehen zu finden, an die Medikamente binden können, die die Zellen ausschalten – und damit potenziell das Tumorwachstum bremsen können.
„Wir brauchen da mehrere Klassen neuer Wirkstoffe, um diesen meist tödlichen Tumor effektiv zu bekämpfen“, erklärt Glaß. Darüber hinaus, so der Biologe, „wird diese Arbeit von besonderem Interesse für die neurowissenschaftliche Grundlagenforschung und die Krebsforschung sein.“
Roland E. Kälin, Linzhi Cai, Yuping Li, et al.: TAMEP are brain tumor parenchymal cells controlling neoplastic angiogenesis and progression. Cell Systems, Open Access, Published: February 15, 2021, DOI: doi.org/10.1016/j.cels.2021.01.002.
Quelle: idw/LMU
Artikel teilen