Ziel des Konsortiums „PancChip“ ist es, Kultur und Differenzierung von Stammzellen zu funktionalen Beta-Zellen auf einem Chip weiterzuentwickeln und so Fragestellungen zur Entstehung und Therapie von Diabetes und anderen Erkrankungen der Bauchspeicheldrüse zu lösen. Die Gesamtfördersumme von 1,5 Millionen Euro wird unter den beteiligten Partnern gedrittelt.
Ersatz- und Regenerationstherapien im Blickfeld
Bei verschiedenen Typen von Diabetes, werden die Insulin produzierenden Beta-Zellen der Bauchspeicheldrüse zerstört. Als Behandlungsmöglichkeit für diesen Fall rücken vermehrt Ersatz- und Regenerationstherapien ins Blickfeld der Wissenschaft. Die Idee dahinter: Stammzellen, also Zellen, die sich in andere Zelltypen entwickeln können, als Quelle für Insulin produzierende Beta-Zellen zu nutzen.
„Leider verfügen wir aber noch nicht über ein ausreichendes Verständnis der Signale und Faktoren, welche die Programmierung der Stammzellen steuern“, erklärt Prof. Dr. Heiko Lickert, Direktor des Instituts für Diabetes- und Regenerationsforschung (IDR) am Helmholtz Zentrum München und Inhaber des Lehrstuhls für Betazellbiologie an der Technischen Universität München (TUM). Er wird das Projekt zusammen mit Dr. Matthias Meier von der Universität Freiburg koordinieren und leiten. Ebenfalls an dem Projekt beteiligt ist Prof. Dr. Alexander Kleger, Oberarzt an der Ulmer Universitätsklinik für Innere Medizin I.
Zellkulturmodelle im Chip-Format
Gemeinsam wollen die Wissenschaftler mehrere Zellkulturmodelle im Chip-Format entwickeln, um zu untersuchen, welche Faktoren die Entwicklung der Stammzellen in endokrine und exokrine* Zelllinien steuern und wie sie das tun. Dafür wachsen die Zellen auf einem Trägermaterial (dem Chip) und die darüber liegenden Flüssigkeiten (Nährmedium mit und ohne zusätzliche Substanzen) werden durch miniaturisierte, pneumatische Ventile gesteuert. Angeschlossen sind zudem Analysemethoden, um die Reaktion der Zellen umfassend zu dokumentieren.
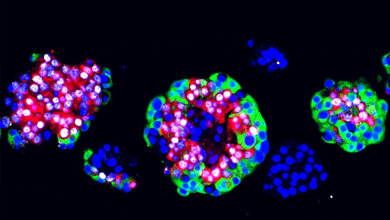
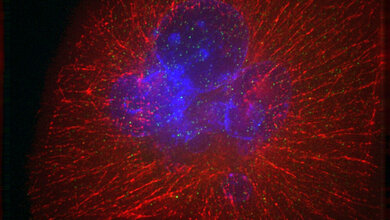
Ein 3D-Modellsystem soll im nächsten Schritt sogenannte Organoide – also Miniorgane – hervorbringen, um Krankheitsprozesse zu untersuchen. „Durch diese ‚Organoid-Klinik‘ können wir Wirkstoffe unter standardisierten Bedingungen testen und die Reaktion von Patienten-Material auf Therapieoptionen untersuchen“, so Projektleiter Lickert. Die Münchner Forscher werden sich dabei vor allem auf die Modellierung von Diabetes spezialisieren, während in Ulm an chronischen Entzündungen der Bauchspeicheldrüse (Pankreatitis) geforscht werden soll.
Heilung von Diabetes mellitus?
Langfristig soll sich das Projekt in drei Richtungen bezahlt machen: wissenschaftlich möchte das Konsortium die Biologie hinter den Pankreas-Krankheiten erschließen und mögliche Eingriffspunkte identifizieren. Klinisch steht die Entwicklung von Beta-Zellersatztherapie und damit langfristig der Heilung des Diabetes mellitus im Mittelpunkt der Arbeiten. Und nicht zuletzt soll auch wirtschaftlich ein Nutzen aus dem Projekt entstehen: Auf Sicht** sollen die Forschungsergebnisse von einem Start-up-Unternehmen verwertet werden. Denkbar wären hier der Chip selbst zur möglichen Produktion von Betazellen aus Stammzellen, eine Hochdurchsatz-Screening-Plattform für Chemotherapeutika mit Wirksamkeit auf Bauchspeicheldrüsenzellen oder auch als neuartiges Instrument zur individualisierten Vorab-Testung von Therapieoptionen an Patientenmaterial. (idw, red)
Hintergrundinformationen:
* Während endokrine Zellen ihre Produkte (wie den Botenstoff Insulin) ins Blut abgeben, entlassen exokrine Zellen Stoffe „nach außen“. Im Kontext der Bauchspeicheldrüse handelt es sich hier oft um Verdauungsenzyme, die in den Zwölffingerdarm abgegeben werden.
** Übertriebene Erwartungen mit Blick auf erste Erfolge wollen die Forscher aber nicht aufkommen lassen. Sie schätzen, dass der Zeitrahmen für die Verwertung der Ergebnisse in der Größenordnung von zehn Jahren liegen wird. Die Laufzeit ist zunächst vom 01. Februar 2017 bis zum 31. Januar 2020 angesetzt.
Technisch basiert das Projekt auf einer mikrofluidischen Zellkultur-Chip-Plattform. Das bedeutet, die Zellen wachsen auf einem Trägermaterial (dem Chip) und die darüber liegenden Flüssigkeiten (Nährmedium mit und ohne zusätzliche Substanzen) werden durch miniaturisierte, pneumatische Ventile gesteuert. Die sogenannte microfluidic large-scale integration technology (mLSI) erlaubt es, die Zellen dann entsprechend zu charakterisieren – das umfasst etwa die gleichzeitige Analyse von verschiedenen Proteinen in und um die Zellen (Multiplex in situ Proteinanalytik) einschließlich deren Interaktionen („proximity ligation assay“), die Bildgebung lebender Zellen („live cell imaging“) sowie das Verfolgen einzelner Zellen während der Differenzierung und vieles mehr.
Artikel teilen