Bisher gab es für das Entfernen prinzipiell zwei Methoden: die Genschere CRISPR/Cas und die RNA-Interferenz, die auf Ebene von DNA und RNA wirken. Ihr Einfluss auf Proteine ist jedoch indirekt und braucht Zeit. Eine neue Methode namens Trim-Away macht es nun möglich, Proteine direkt und schnell in jeder Art von Zelle abzubauen. Da Trim-Away zwischen Varianten eines Proteins unterscheiden kann, eröffnet es neue Ansätze für die Therapie von Krankheiten.
Wie arbeiten Proteine in ihrem natürlichen Umfeld?
In jeder lebenden Zelle sind Zigtausende Proteine am Werk. Ihr Repertoire reicht von der Katalyse biochemischer Reaktionen über das Ausformen der Zelloberfläche bis hin zum Senden und Empfangen von Signalen. In ihrer Funktion gestörte Proteine verursachen zahlreiche Krankheiten wie Krebs oder Neurodegeneration. Daher wollen Molekularbiologen verstehen, wie Proteine in ihrem natürlichen Umfeld – der Zelle – arbeiten.
Um die Funktion eines Proteins zu erforschen, ist eine der wichtigsten Strategien, es aus der Zelle zu entfernen und zu untersuchen, wie sich dies auf zelluläre Prozesse auswirkt. Die dafür genutzten Techniken CRISPR/Cas und RNA-Interferenz (RNAi) schalten zwar die Produktion eines Proteins effizient ab. Allerdings beeinflussen sie die Menge eines Proteins nur indirekt. Außerdem sind sie nicht auf jede Art von Zelle und Protein anwendbar. Bisher gab es keine allgemein geeignete Methode, die diese Beschränkungen überwinden konnte.
Jedes beliebige Protein in jedem beliebigen Zelltyp abbauen
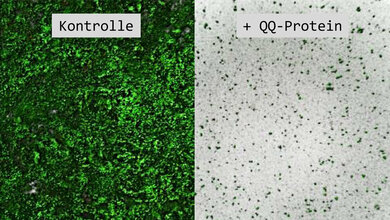
Wissenschaftler am Max-Planck-Institut (MPI) für biophysikalische Chemie in Göttingen und am Medical Research Council Laboratory of Molecular Biology (MRC LMB) in Cambridge (Großbritannien) ist es jetzt gelungen, eine neue Methode zu entwickeln, die sich Trim-Away (übersetzt etwa: wegschneiden) nennt. „Mit Trim-Away ist es erstmals möglich, so ziemlich jedes beliebige Protein in jedem beliebigen Zelltyp abzubauen“, erläutert Melina Schuh, Direktorin am MPI für biophysikalische Chemie. „Es ist sehr einfach anzuwenden und entfernt Proteine in nur wenigen Minuten. Das ist bedeutend schneller als alles, was sich mit CRISPR/Cas oder RNAi erreichen lässt – mit diesen Techniken dauert es typischerweise Stunden bis Tage, bis ein Protein entfernt ist. Das gibt der Zelle Zeit, Wege zu finden, den Verlust zu kompensieren. Das verschleiert manchmal die tatsächlichen Effekte. Außerdem eignen sich CRISPR/Cas und RNAi nicht, um langlebige Proteine und Proteine aus Primärzellen zu untersuchen. Mit Trim-Away können wir diese Lücke nun schließen.“ „Wir können jetzt im Prinzip jede beliebige Zelle aus dem Körper nehmen und Proteine in dieser Zelle schnell zerstören, um die Auswirkungen auf zelluläre Prozesse unmittelbar zu untersuchen“, ergänzt Erstautor Dean Clift.
Die neue Methode nutzt die Fähigkeiten eines zellulären Proteins
Im Zentrum der neuen Methode steht ein Protein, das im Labor von Leo James am MRC LMB entdeckt wurde: Trim21. Trim21 erkennt Antikörper, die an Viren geheftet in die Zelle gelangen. Es bindet an diese Antikörper, markiert den Komplex aus Antikörper und Virus als „Müll“ und übergibt ihn an den zellulären „Müllschlucker“, das Proteasom.
Schuh erkannte, dass diese Fähigkeit von Trim21 ihr dabei helfen konnte, ein Problem zu lösen, auf das sie in ihrer Forschung gestoßen war: Es hatte sich als ausgesprochen schwierig erwiesen, bestimmte Proteine mittels CRISPR/Cas oder RNAi aus Eizellen zu entfernen, da viele dieser Proteine sehr langlebig sind. Schuh wollte Trim21 nun als molekulares Werkzeug nutzen: Gemeinsam mit Clift schleuste sie Antikörper in die Zellen, die nicht gegen ein Virus, sondern gegen ein bestimmtes zelluläres Protein gerichtet waren. Trim21 erkannte den Antikörper und lieferte das von ihm markierte Protein zur Zerstörung an das Proteasom. Innerhalb von Minuten verschwand es aus der Zelle. Diese Ausrichtung von Trim21 auf ein zelleigenes Protein ist das zentrale Prinzip von Trim-Away. „Im Grunde hat uns der Werkzeugkasten der Natur alle notwendigen Komponenten zur Verfügung gestellt. Der Trick war, die richtigen auszuwählen und zu einem System zu kombinieren, das unseren Zwecken dient“, fasst Schuh zusammen.
„Elektroschock“ für die Zelle
Eine Schwierigkeit bestand darin, dass in vielen Zelltypen die Mengen von Trim21 nicht ausreichen, um alle Antikörper-gebundenen Proteine zu entfernen. Die Forscher lösten dieses Problem, indem sie zusammen mit dem Antikörper zusätzliche Trim21-Proteine in die Zellen schleusten. Ein kleiner „Elektroschock“ brachte die Zellen dazu, die Proteine aufzunehmen.
„Als wir vor über zehn Jahren erstmals Trim21 als Antikörper-Rezeptor identifiziert hatten und anschließend zeigen konnten, wie effizient es virale Proteine zerstört, vermuteten wir, dass es ein wirksames Werkzeug sein könnte, wenn man es gegen zelluläre Proteine richtet. Das Ergebnis ist jetzt aber noch viel eindrücklicher als wir uns hätten träumen lassen“, sagt James. Dies gilt auch für die Anwendbarkeit von Trim-Away auf langlebige Proteine und Primärzellen, also Zellen, die direkt aus Gewebe entnommen wurden.
Eine weitere Anwendung liegt in Makrophagen, die zu den weißen Blutkörperchen gehören: „Makrophagen sind komplett unzugänglich für CRISPR/Cas und RNAi, da sie besonders gut darin sind, fremde DNA und RNA zu erkennen, und das sind zentrale Komponenten dieser Techniken“, erklärt James. „Mit Trim-Away ist es jetzt möglich, Proteine aus Makrophagen zu entfernen, um ihre Funktion in diesem Zelltyp zu untersuchen.“
Krankmachende Proteinvarianten zerstören?
Trim-Away kann sich die bemerkenswerte Spezifität von Antikörpern zunutze machen, die nicht nur zwischen unterschiedlichen Proteinen, sondern auch zwischen zwei Varianten desselben Proteins unterscheiden können. Diese Varianten spielen in vielen Krankheiten eine Rolle. Ein prominentes Beispiel ist Chorea Huntington, eine erbliche neurodegenerative Erkrankung. Bei Betroffenen ist eine der beiden Gen-Kopien mutiert, die die Bauanleitung für das Protein Huntingtin liefern. Die Wissenschaftler zeigten, dass Trim-Away die krankmachende Variante von Huntingtin aus Gewebekulturzellen entfernen kann, während die „normale“ Variante unberührt bleibt. „Natürlich ist es etwas völlig anderes, dies in einer Zellkultur zu erreichen als die Krankheit zu heilen“, betont Schuh. „Eine therapeutische Anwendung ist noch weit entfernt. Aber unsere Arbeit eröffnet neue Möglichkeiten, um in Zukunft Krankheiten mit Antikörpern behandeln zu können. (idw, red)
Dean Clift, William A. McEwan, Larisa I. Labzin, et al.: A method for the acute and rapid degradation of endogenous proteins. Cell, DOI: 10.1016/j.cell.2017.10.033 (2017).
Artikel teilen