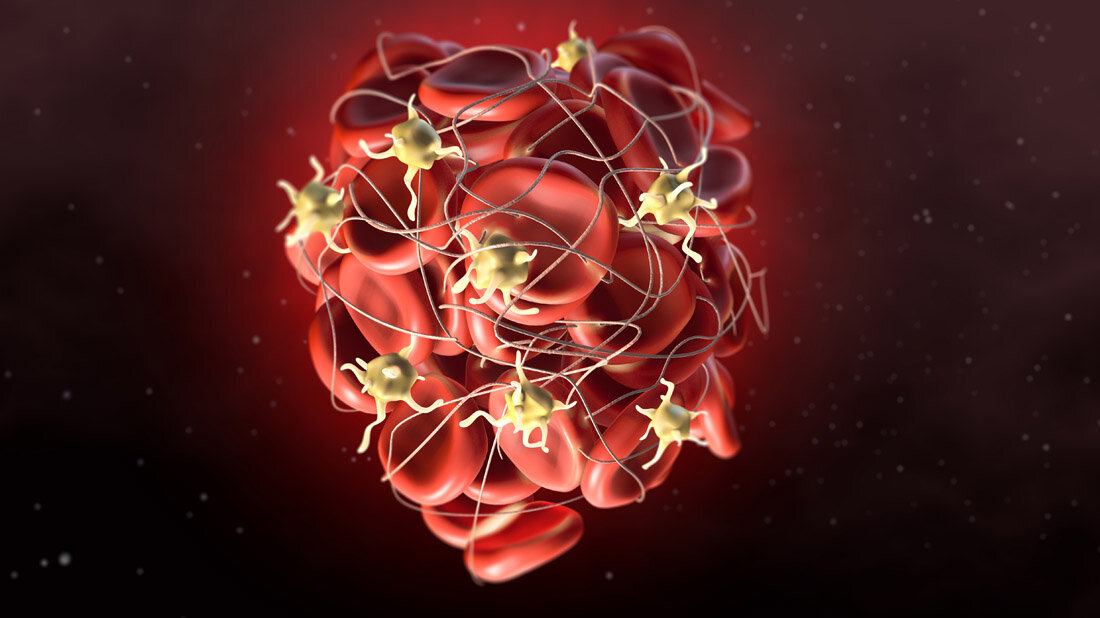
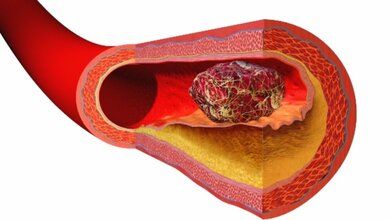
Thrombosen können in Venen oder in Arterien auftreten. Arterielle Thrombosen können zu Herzinfarkten oder Schlaganfällen führen. Im Krankheitsprozess spielen Blutplättchen (Thrombozyten) eine zentrale Rolle. Ärztinnen und Ärzte versuchen, mit Medikamenten zu verhindern, dass diese Zellen aggregieren. „Die bisherigen Therapien sind effizient, haben jedoch als Schwachpunkte, dass es zu Blutungen kommen kann oder dass dennoch Thrombosen auftreten“, sagt Privatdozent Dr. Philipp von Hundelshausen vom LMU-Institut für Prophylaxe und Epidemiologie der Kreislauferkrankungen und vom Deutsches Zentrum für Herz-Kreislauf-Forschung (DZHK). „Um neue Therapieformen zu entwickeln, ist es wichtig, Pathomechanismen auf molekularer Ebene zu verstehen.“
Signalweg lässt sich noch nicht medikamentös beeinflussen
In einer Studie berichtet von Hundelshausens Team über einen neuen Signalweg der Blutgerinnung, der sich bislang nicht medikamentös beeinflussen lässt. Gleichzeitig zeigen die Forscher, wie sich dieser Weg experimentell hemmen lässt, um das Thrombose-Risiko zu verringern. Koautor der Studie ist Professor Dr. Christian Weber, Direktor des LMU-Instituts für Prophylaxe und Epidemiologie der Kreislauferkrankungen. „Wir haben verschiedene bekannte Puzzlesteine über arterielle Thrombosen zusammengesetzt und daraus eine neue Hypothese zum Molekül CXCL12 entwickelt“, berichtet von Hundelshausen. Bekannt war, dass CXCL12, ein körpereigener Botenstoff, Blutplättchen im Reagenzglas aktivieren kann, was zur Blutgerinnung führt. Forscher wussten auch, dass dies über CXCR4 als Bindungsstelle geschieht. Dieser Rezeptor ist auf allen Blutplättchen zu finden. Er sorgt für die Chemotaxis, also die gerichtete Fortbewegung von Zellen entlang von Konzentrationsunterschieden bestimmter Chemikalien. Gleichzeitig ist bekannt, dass Blutplättchen CXCL12 herstellen.
Künstliche Variante des Hemmstoffs
In früheren Experimenten hatten die Forscher ein Molekül entdeckt, das an CXCL12 bindet und diesen Botenstoff hemmt. Basierend auf dem Bauplan stellten sie eine künstliche Variante des Hemmstoffs her. Zu dem Zeitpunkt war aber noch unklar, ob CXCL12 überhaupt eine Bedeutung bei arteriellen Thrombosen hat. Die Experimente zeigten nur eine Plättchenaktivierung. Auch die Herkunft von CXCL12 erwies sich als rätselhaft. Anhand von Tierexperimenten konnten die LMU-Forscher aber zeigen, dass CXCL12 tatsächlich – wie vermutet – bei der Entstehung von Thrombosen eine Rolle spielt. Das zeigten sie anhand gezielter, chemischer Verletzungen der Halsschlagader von Mäusen.
Blutgefäße verschlossen sich seltener
Die Wissenschaftlerinnen und Wissenschaftler haben per Gentechnologie ein Mausmodell hergestellt, bei dem CXCL12 überall hergestellt wird, wo es normalerweise produziert wird, nur nicht von Blutplättchen. Dabei zeigte sich, dass sich Thrombosen später als bei Wildtyp-Mäusen bildeten – und sich auch schneller wieder auflösten. Bei genetisch veränderten Mäusen verschlossen sich Blutgefäße seltener. Im nächsten Schritt hat von Hundelshausens Team die Situation durch chemische Hemmung von CXCL12 mit dem zuvor hergestellten Molekül nachgeahmt. Spritzten Forscher Mäusen die Substanz, bevor sie eine Thrombose auslösten, entstanden weitaus weniger Thrombosen – und die Gerinnsel zerfielen auch schneller wieder als bei unbehandelten Tieren.
Was passiert bei Hemmung von CXCL12?
Als Frage blieb, was bei der Hemmung von CXCL12 genau passiert. Weitere Untersuchungen zeigten, dass die sogenannte Bruton-Tyrosinkinase eine Schlüsselrolle spielt. Das Enzym ist ein Kandidat für die Behandlung von Blutkrebs, spielt aber auch bei der Blutgerinnung eine Rolle: Hemmt man die Bruton-Tyrosinkinase mit bekannten Medikamenten aus der Onkologie, verliert auch CXCL12 die Wirkung. Alle Studienergebnisse kommen aus Labor- und aus Tierexperimenten. Dennoch wagen die Forscher folgendes Gedankenexperiment: Nach einem Herzinfarkt erhalten manche Patienten Acetylsalicylsäure plus Clopidogrel, um zu vermeiden, dass neue Blutgerinnsel entstehen. „Beide Arzneistoffe führen jedoch zu einer unvollständigen Plättchenhemmung“, sagt von Hundelshausen. „In bestimmten Situationen, etwa bei der zusätzlichen Plättchenaktivierung durch Kollagen, könnte der neue Hemmstoff einen zusätzlichen Nutzen bringen, ohne das Blutungsrisiko zu erhöhen.“
Quelle: idw/LMU
Artikel teilen