Vermehrungszyklus des Malariaerregers besser verstehen
Einen neuen Einblick in den ungewöhnlichen Vermehrungszyklus des Malariaerregers Plasmodium haben Wissenschaftlerinnen und Wissenschaftler des Universitätsklinikums (UKHD) und der Universität Heidelberg aktuell veröffentlicht: Die Forschungsergebnisse liefern eine Erklärung dafür, warum sich die parasitischen Einzeller in befallenen roten Blutkörperchen nicht einfach mehrmals in Folge verdoppeln, wie dies die meisten anderen Zellen tun. Stattdessen teilen sie zunächst scheinbar unkoordiniert und asynchron ihre Zellkerne, die das Erbgut des Erregers enthalten, erst dann bilden sich um diese herum die Tochterzellen. Die Wissenschaftler vermuten, dass sich die neu entstehenden Zellkerne durch die fehlende Synchronisation nicht gegenseitig die knappen Ressourcen in den nährstoffarmen Blutzellen streitig machen und sich die Parasiten daher schneller vermehren können. Die Ergebnisse helfen dabei, die Vermehrungsmechanismen des weit verbreiteten und bislang schwer einzudämmenden Erregers besser zu verstehen.
Komplexer Entwicklungszyklus
Der Entwicklungszyklus des Malariaerregers, der aus nur einer einzelnen Zelle besteht, ist komplex: Durch einen Mückenstich übertragen, wandern die Parasiten von der Einstichstelle in die Blutgefäße und von dort weiter in die Leber, wo sie sich vermehren, dann die Leber verlassen, rote Blutkörperchen befallen und sich dort erneut rasant vermehren. Befall und Zerstörung der Blutzellen verursacht Fieberschübe, Gefäßverschlüsse und Gewebeschäden. Viele Details der einzelnen Entwicklungsschritte stellen die Wissenschaftlerinnen und Wissenschaftler bis heute vor Rätsel – darunter die ungewöhnliche Vermehrung in den Blutzellen: In der Regel vermehren sich einzelne Zellen, indem sie sich in zwei Tochterzellen teilen. Beim Malariaerreger teilt sich zunächst nur der Zellkern, in dem das Erbgut gelagert ist, und zwar gleich mehrmals, bis rund 20 Zellkerne in einer einzigen Zelle entstanden sind. Erst dann werden sie in neue Parasiten verpackt, platzen aus der Blutzelle und befallen die nächsten roten Blutkörperchen.
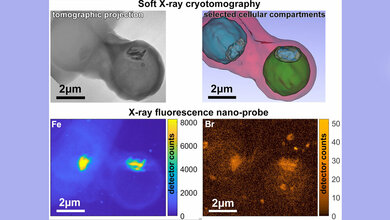
Nutzung von Mikroskopie und mathematischen Modellen
„Einzigartig ist dabei vor allem die Autonomie der Zellkerne: Obwohl sie sich in einer einzigen Zelle befinden, teilen sich die Zellkerne nicht synchron auf ein zentrales Signal hin, sondern scheinbar unabhängig voneinander. Die Frage nach dem ‚Warum‘ haben wir nun erstmals dank einer Kombination von modernen mikroskopischen Methoden und mathematischen Modellen beantwortet“, erläutert Seniorautor Dr. Markus Ganter, Arbeitsgruppenleiter in der Abteilung für Parasitologie, Zentrum für Infektiologie am UKHD. Die veröffentlichte Arbeit ist ein gemeinsames Projekt von Arbeitsgruppen des UKHD, der Universität Heidelberg und des Deutschen Krebsforschungszentrums (DKFZ) um Dr. Ganter, Professor Dr. Friedrich Frischknecht, Abteilung für Parasitologie am Zentrum für Infektiologie, Professor Dr. Ulrich Schwarz, BioQuant und Institut für Theoretische Physik, Universität Heidelberg, sowie Professor Dr. Thomas Höfer, Leiter der Abteilung Theoretische Systembiologie am DKFZ, die im Rahmen des von Heidelberg aus koordinierten Sonderforschungsbereichs „Integrative Analyse der Reproduktion und Ausbreitung von pathogenen Erregern (SFB 1129)“ zusammenarbeiten.
Teilung stoppt bei ungefähr 20
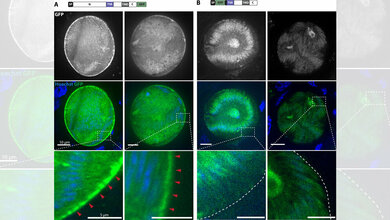
Mit Hilfe eines fluoreszierenden Parasitenstamms analysierten die Forscher die Dynamik der ersten Kernteilungen in lebenden Zellen unter dem Mikroskop und entwickelten daraus ein mathematisches Modell, um die Kernteilung über den gesamten Entwicklungsschritt zu simulieren. Dabei fanden sie heraus: Die Teilung der Parasitenkerne verläuft nur anfangs scheinbar unkoordiniert. Die Mutterzelle zählt mit und stoppt die Teilungen bei ungefähr 20 Kernen, sodass alle Kerne gleichzeitig in neue Tochterzellen verpackt werden können. Darüber hinaus verlangsamt sich die Teilungsgeschwindigkeit mit der Anzahl der Kerne.
Notwendigkeit einer schnellen Vermehrung
„Der Grund dafür sind wahrscheinlich die begrenzten Ressourcen in den Blutzellen“, erläutert Ganter. „Je mehr Kerne es gibt, desto häufiger kommt es vor, dass sich zwei oder mehr von ihnen zufällig zur selben Zeit teilen und gleichzeitig bestimmte, nur begrenzt zur Verfügung stehende Stoffe benötigen. Die Abläufe verlangsamen sich. Im Umkehrschluss bedeutet dies, dass die Vermehrung schneller geht, wenn sich die Kerne nicht zur gleichen Zeit verdoppeln. Diese Teilungsstrategie könnte also der Notwendigkeit einer schnellen Vermehrung geschuldet sein.“ Weitere Experimente konnten diese Vorhersage bestätigen. Die Ergebnisse deuten somit darauf hin, dass es einen evolutionären Druck gibt, der eine asynchrone DNA-Replikation begünstigt und ein Gleichgewicht zwischen den verfügbaren Ressourcen und der schnellen Vermehrung von Krankheitserregern schafft.
Quelle: idw/Universitätsklinikum Heidelberg
Artikel teilen