Pilzinfektion: Was macht A. fumigatus so gefährlich?
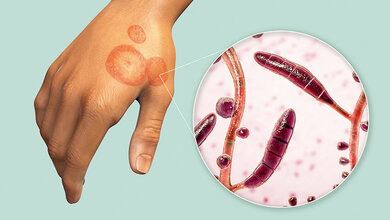
Aspergillus fumigatus ist ein weltweit verbreiteter Schimmelpilz. Die Pilzstämme, die in der Umwelt vorkommen und die klinischen Stämme aus Patientenproben unterscheiden sich jedoch deutlich. Im Gegensatz zu eng verwandten Arten kann er beim Menschen schwere, oft tödlich verlaufende Infektionen auslösen. Doch was macht gerade A. fumigatus so gefährlich? Hinweise auf die Ursache fand ein internationales Forschungsteam unter der Leitung von Gustavo Goldman von der Universität São Paulo in Brasilien: Ein spezielles Enzym auf der Oberfläche der Pilzsporen – die Glykosylasparaginase – unterdrückt offenbar die Ausschüttung entzündungsfördernder Stoffe durch Immunzellen und erleichtert dem Erreger damit die ungehinderte Ausbreitung im Gewebe.
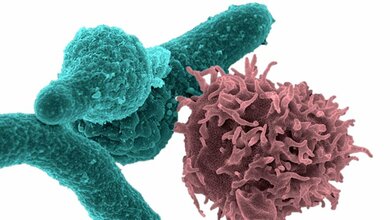
Interaktion des Pilzes mit Immunzellen
„Gustavo Goldmans Gruppe interessierte sich besonders für die Oberflächenproteine auf den Sporen, denn die kommen – meist durch Einatmen – als erste in Kontakt mit dem Immunsystem“, berichtet Olaf Kniemeyer vom Leibniz-Institut für Naturstoff-Forschung und Infektionsbiologie – Hans-Knöll-Institut (Leibniz-HKI), dem deutschen Partner der Studie. Kniemeyer ist Proteomik-Experte. Mit seinem Team analysiert er die Gesamtheit aller Proteine einer Zelle und ordnet ihnen Funktionen zu. So findet er mögliche Angriffspunkte für neue Wirkstoffe. Außerdem sind die Forschenden aus Jena spezialisiert auf die Phagozytose, ein Abwehrmechanismus, bei dem Immunzellen fremde Eindringlinge auffressen. So konnte das internationale Forschungsteam auch die Interaktion des Pilzes mit Immunzellen studieren.
Glycosylasparaginase dämpft die Immunreaktion
In der aktuellen Studie wandten sie die Methode der Trypsin-Rasur an: Mit Hilfe von Trypsin, einem Protein-spaltenden Enzym, entfernten sie alle Proteine von der Sporenoberfläche und analysierten deren Bruchstücke im Massenspektrometer. Über Datenbankvergleiche konnten sie 62 Proteine identifizieren, die nur auf den Sporen von A. fumigatus, nicht jedoch auf eng verwandten Arten vorkommen. Einige von ihnen könnten demnach im Infektionsgeschehen eine Rolle spielen. Um dies zu prüfen, erzeugten die Forschenden eine Knockout-Bibliothek mit 42 Mutanten des Schimmelpilzes, bei denen jeweils ein Gen ausgeschaltet war, das für eines dieser Proteine codierte. Die Mutante, der die Glykosylasparaginase fehlte, habe dann bei Immunzellen eine verstärkte Ausschüttung von Interleukin-1β ausgelöst. Interleukine sind hochwirksame Proteine, die in geringsten Mengen Fieber, Entzündungen und eine Reihe weiterer Immunreaktionen auslösen und damit die Abwehr von Krankheitserregern bewirken. Fehlt nun die Glycosylasparaginase auf den Pilzsporen, könne das Immunsystem mehr von diesem Entzündungsstoff freisetzen. Immunzellen werden aktiviert und können den Pilz besser abwehren. Laut Wissenschaftler/-innen deute dies im Umkehrschluss darauf hin, dass die vom Pilz produzierte Glycosylasparaginase normalerweise dazu beitrage, die Immunreaktion zu dämpfen. So könne der Pilz den Körper nahezu ungehindert infizieren.
Neue Therapien möglich?
Bei Mäusen mit einem intakten Immunsystem sei der Pilz stärker vom Immunsystem angegriffen worden, wenn ihm zuvor das Gen für die Glycosylasparaginase ausgeschaltet worden sei. Entsprechend unterstütze die Untersuchung im Mausmodell die aufgestellte Hypothese: „Die Glykosylasparaginase auf den Sporen von Aspergillus fumigatus spielt also eine Rolle bei der Auseinandersetzung mit dem Immunsystem. Wie dieser Mechanismus genau funktioniert, können wir jetzt aber noch nicht sagen“, fasst Kniemeyer die Ergebnisse der Studie zusammen. Die Erkenntnisse könnten durchaus helfen, neue Therapien für Infektionen mit A. fumigatus zu entwickeln. Das sei dringend erforderlich, da es heute nur wenige wirksame Medikamente zur Bekämpfung von Pilzinfektionen gebe und sich allmählich Resistenzen dagegen verbreiten, betonen die Wissenschaftler/-innen.
Quelle: idw/Leibniz-HKI
Artikel teilen