Bakterien müssen sich vor Amöben in Acht nehmen. Denn hungrige Amöben machen Jagd auf sie. Sie fangen die Bakterien mit ihren Scheinfüßchen, verleiben sie sich ein und verdauen sie schließlich. Allerdings gibt es auch Bakterien, die sich zu wehren wissen. Amoebophilus ist so eines. Forschende der Universität Wien haben es vor einigen Jahren entdeckt. Das Bakterium kann im Innern von Amöben überleben. Mehr noch: Es hat sich das Amöbeninnere sogar zu seinem bevorzugten Lebensraum gemacht.
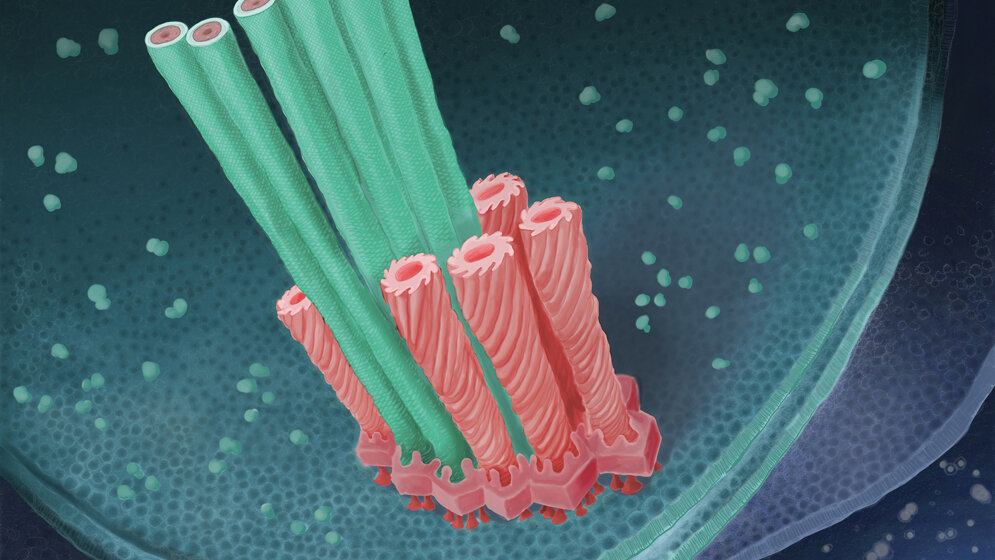
Wissenschaftler der ETH Zürich fanden nun gemeinsam mit den Wiener Entdeckern des Bakteriums einen Mechanismus, von dem sie annehmen, dass er für das Überleben von Amoebophilus im Amöbeninnern zentral ist. Das Bakterium besitzt Mikro-Dolche und geeignete Ausfahrvorrichtungen. Mit den Dolchen kann es die Amöben von innen piesacken und dadurch dem Verdautwerden entkommen.
Befreiung aus dem Amöbenmagen
Die Ausfahrvorrichtung besteht aus einem Mantelrohr, das über eine Grundplatte und eine Verankerung innen an der Membran des Bakteriums befestigt ist. João Medeiros, Doktorand in der Gruppe von ETH-Professor Martin Pilhofer erklärt den Mechanismus: „Das Mantelrohr steht unter Federspannung, und in dessen Innern liegt der Mikro-Dolch. Zieht sich das Mantelrohr zusammen, wird der Dolch durch die Bakterienmembran extrem schnell nach außen gedrückt.“
Einverleibte Bakterien befinden sich in den Amöben in einem spezialisierten und von einer Membran umgebenen Verdauungskompartiment. „Unsere Forschungsresultate legen nahe, dass die Bakterien in der Lage sind, die Dolche in die Membran des Amöben-Verdauungskompartiments zu stoßen“, sagt Désirée Böck, ebenfalls Doktorandin in Pilhofers Gruppe und Erstautorin der veröffentlichten Arbeit. Dies führt dazu, dass das für die Bakterien unwirtliche Kompartiment zerfällt und die Bakterien freigibt. Außerhalb des Verdauungskompartiments, aber immer noch im Innern der Amöben, können die Bakterien prima überleben und sich sogar vermehren.
Wie genau das Verdauungskompartiment zerstört wird, ist noch nicht bekannt. „Möglicherweise reißt die Hülle allein aus mechanischen Gründen“, sagt Pilhofer. Denkbar sei aber auch, dass die Dolche der Amoebophilus-Bakterien mit einer Art Pfeilgift – mit membranabbauenden Enzymen – imprägniert seien. Im Erbgut der Bakterien sind die Bauanleitungen für solche Enzyme vorhanden, wie Matthias Horn, Professor an der Universität Wien, und seine Mitarbeitenden zeigen konnten.
Präzisionsfräsen
Mit einer ganz neuen Methode, die erst von einer Handvoll Forschungslabors weltweit angewandt wird, darunter jenem von ETH-Professor Pilhofer, konnten die Wissenschaftler die dreidimensionale Struktur der Dolche und ihrer Ausfahrvorrichtungen hochauflösend ermitteln. Doktorandin Böck fror dazu Amöben mit einverleibten Bakterien bei minus 180 Grad Celsius ein.
Vergleichbar mit einem Paläontologen, der mit Hammer und Meißel Fossilien aus einem Stein freilegt, bearbeitete Doktorand Medeiros mit einem fein fokussierten Ionenstrahl (engl. focused ion beam) als „Nanomeißel“ die tiefgefrorenen Proben: In beeindruckender Präzisionsarbeit konnte er die Amöbe und einen Großteil des Bakteriums wegfräsen und so die molekularen Dolche und ihre Abschussvorrichtungen freilegen, um davon schließlich ein dreidimensionales Elektronentomogramm zu erstellen. ###more###
Erstes Bild der Gesamtstruktur
Mit der Dolch-Ausstoßvorrichtung verwandte Systeme gibt es auch andernorts in der Biologie: Sich auf die Infektion von Bakterien spezialisierte Viren (Bakteriophagen) injizieren mit solchen Systemen ihr Erbgut in Mikroorganismen. Und es gibt sogar Bakterien, welche solche Mikroapparate in die Umgebung absondern können, wo sie konkurrierende Mikroorganismen bekämpfen.
In ihrer Arbeit präsentieren die Wissenschaftler zum ersten Mal im natürlichen Kontext die gesamte räumliche Struktur einer Ausstoßvorrichtung, die sich im Innern einer Zelle befindet. Außerdem zeigen die Forschenden zum ersten Mal, wie die Grundplatte und die Verankerung dieser Ausstoßvorrichtung aussehen. „In der Vergangenheit untersuchten Zellbiologen die Funktion solcher Systeme, und Strukturbiologen konnten die Struktur einzelner Bestandteile aufklären“, sagt Pilhofer. „Mit der von uns an der ETH etablierten Technik, dem Kryo-Ionenstrahl-Fräsen und der Kryo-Elektronentomographie, können wir nun jedoch die Brücke schlagen zwischen der Zellbiologie und der Strukturbiologie.“
Mehrläufige Kanonen
Bisher bekannte Mikro-Injektionsapparate treten einzeln auf. Die Wissenschaftler aus Zürich und Wien haben in Amoebophilus nun erstmals Apparate gefunden, die in Bündeln bis zu rund 30 solcher Apparate vorkommen. „Man könnte auch von mehrläufigen Kanonen sprechen“, sagt Pilhofer.
Mit Erbgutvergleichen gingen die Forschenden außerdem der Frage nach, wie Amoebophilus im Laufe der Evolutionsgeschichte zu seinen Dolch-Ausstoßvorrichtungen gekommen ist. „Die entsprechenden Gene haben große Ähnlichkeit mit jenen der Injektionssysteme von Bakteriophagen“, sagt Pilhofer. „Wir gehen davon aus, dass sich die Gene von Vorläufern heutiger Bakteriophagen vor langer Zeit ins Erbgut der Bakterien eingenistet haben.“
Bei weiteren Bakterien ebenfalls vorhanden
Die Erbgutvergleiche legen zudem nahe, dass die neuentdeckten Mikro-Dolche nicht nur bei Amoebophilus vorkommen, sondern darüber hinaus bei zahlreichen weiteren Bakterienarten aus mindestens neun der wichtigsten Bakteriengruppen. Ob diese Bakterien ihre Dolche ebenfalls verwenden, um nicht von Amöben verdaut zu werden, oder ob die Dolche noch ganz anderen Zwecken dienen, müssen die Forschenden erst noch untersuchen. So schnell wird ihnen die Arbeit nicht ausgehen.
Und schließlich möchten die Wissenschaftler die neue Methode, das Kryo-Ionenstrahl-Fräsen, für die Strukturaufklärung weiterer komplexer Molekülsysteme verwenden. „Die Technik dürfte für viele Fragen der Zell-, Infektions- und Strukturbiologie interessant sein. Bereits jetzt arbeiten wir mit anderen Forschungsgruppen zusammen und bieten ihnen unsere Expertise an“, sagt ETH-Doktorand Medeiros. (idw, red)
Böck D, Medeiros JM, Tsao HF, Penz T, Weiss GL, Aistleitner K, Horn M, Pilhofer M: In situ architecture, function, and evolution of a contractile injection system. Science, 17. August 2017, DOI: 10.1126/science.aan7904.
Artikel teilen