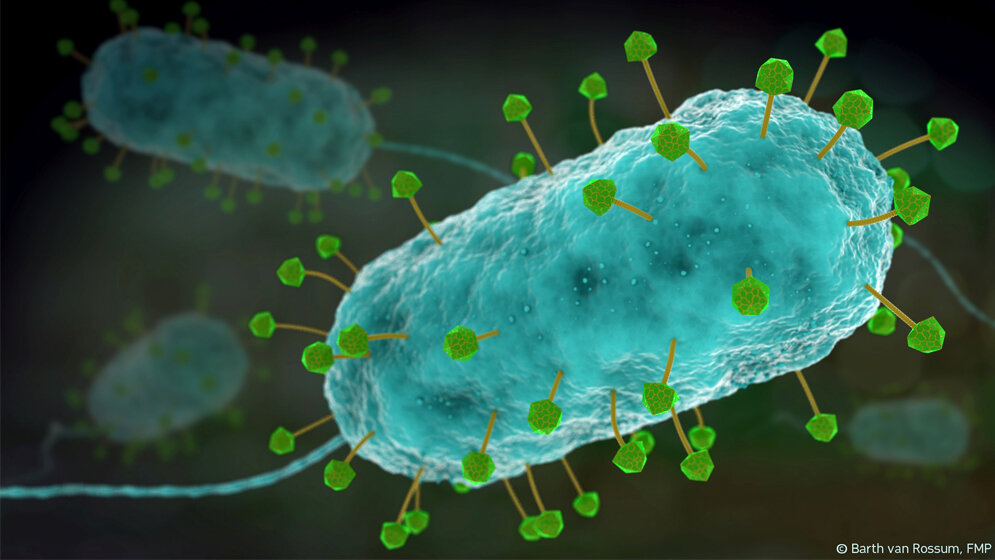
Forscher vom Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) in Berlin konnten jetzt eine neue Methode entwickeln, mit der sich die komplexe Struktur der Viren bis ins atomare Detail aufklären lässt. Die Arbeit basiert auf einer Weiterentwicklung der Festkörper-NMR und wurde kürzlich publiziert.
Suche nach neuen Antibiotika problematisch
Die WHO hat Antibiotikaresistenzen längst zu einer globalen Gesundheitskrise erklärt und zuletzt im März eine Liste mit Problemkeimen veröffentlicht, für die am dringendsten neue Antibiotika benötigt werden. Doch die Suche nach neuen Antibiotika gestaltet sich schwierig: Seit über 40 Jahren gab es keine wesentlichen Fortschritte in der Entwicklung. Forscher suchen darum verstärkt nach therapeutischen Alternativen. Eine solche Alternative könnten Phagen darstellen. Das sind natürlich vorkommende Viren, die bestimmte Bakterien angreifen und fressen und darum auch „Bakteriophagen“ heißen (altgriechisch φαγεῖν phageín ‚fressen‘).
Da es für jedes Bakterium spezifische Phagen gibt, scheinen sie sogar gezielter einsetzbar zu sein als Antibiotika, die immer auch „gute“ Bakterien töten. In Osteuropa wurde bereits viel mit Bakteriophagen experimentiert, und in den USA werden sie inzwischen genetisch so manipuliert, dass sie in der Lage sind, Mäuse von Infektionen mit multiresistenten Keimen zu heilen.
Genaue Aufbau der Phagen bisher nicht bekannt
Der genaue Aufbau der Phagen ist bislang nicht komplett bekannt. Dabei wäre es im Zuge der aktuellen Therapieentwicklung enorm wichtig zu wissen, wie sie genau operieren und wie ihre 3-D-Struktur im atomaren Detail aussieht. „Phagen sind von der Natur über Millionen von Jahren optimierte Nanomaschinen. Sie bestehen aus vielen Komponenten, die sich zu einer komplexen Architektur zusammenfügen“, erklärt Prof. Dr. Adam Lange vom Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP). Lange und seinem Team ist jetzt ein methodischer Meilenstein gelungen: Die Forscher haben Festkörper-NMR-Methoden (Kernspinresonanzspektroskopie) so weiterentwickelt, dass sich damit die Struktur der Phagen bis ins atomare Detail aufklären lässt. Etwa ein Jahr, schätzt Lange, wird er brauchen, um die komplexe Struktur der Phagen aufzuklären. „Damit können wir im Rahmen der Grundlagenforschung einen wichtigen Beitrag zur Phagentherapie leisten.“
Ausführliches Protokoll publiziert
Die neue Methode kann auch auf andere wichtige Systeme angewendet werden. Damit Labore auf der ganzen Welt darauf zurückgreifen können, haben die Forscher zusätzlich zu der Arbeit in „Angewandte Chemie“* ein ausführliches Protokoll in „Nature Protocols“** publiziert.
„Bakteriophagen werden aufgrund der Antibiotikaresistenz vieler pathogener Bakterienstämme als alternativer therapeutischer Ansatz immer wichtiger“, schließt Lange, der einer der führenden Köpfe auf dem Gebiet der NMR-basierten Sichtbarmachung von Proteinstrukturen ist. „Darum werden wir unsere technische Weiterentwicklung jetzt nutzen, um deren komplexe Struktur so schnell wie möglich aufzuklären.“ (idw, red)
*M. Zinke, P. Fricke, C. Samson, S. Hwang, J. S. Wall, S. Lange, S. Zinn-Justin, and A. Lange: Bacteriophage tail tube assembly studied by proton-detected 4D solid-state NMR. Angewandte Chemie – International Edition, in press, DOI: 10.1002/anie.201706060.
**P. Fricke, V. Chevelkov, M. Zinke, K. Giller, S. Becker, and A. Lange: Backbone assignment of perdeuterated proteins by solid-state NMR using proton-detection and ultrafast magic-angle spinning. Nature Protocols, in press, DOI: 10.1038/nprot.2016.190.
Artikel teilen