Chronische Virus-Infektionen: Wie verändert sich die T-Zellen-Antwort?
„Die COVID-19-Pandemie macht deutlich, wie wichtig es ist, die Reaktion des Immunsystems auf Virus-Infektionen zu verstehen“, sagt Dr. Kilian Schober. Zusammen mit einem interdisziplinären Team von Forscherinnen und Forschern aus Medizin, Biologie und Bioinformatik hat er untersucht, wie wichtige Akteure der Körperabwehr – die T-Lymphozyten oder kurz T-Zellen – reagieren, wenn ein Zytomegalievirus in den Organismus eindringt und wie sich die Immunantwort verändert, wenn die Infektion chronisch wird. Mehr als die Hälfte der Weltbevölkerung trägt das Zytomegalievirus in sich.
T-Zell-Antwort ist dynamischer Vorgang
Das Team konnte in der veröffentlichten Studie zeigen, dass die T-Zell-Antwort ein dynamischer Vorgang ist: In verschiedenen Phasen der Virus-Infektion sind unterschiedliche T-Zellen mit unterschiedlichen Rezeptoren besonders aktiv. „Die Entdeckung dieser zeitlichen Veränderung war für uns eine große Überraschung“, sagt Erstautor Schober. Bisher waren die Wissenschaftlerinnen und Wissenschaftler davon ausgegangen, dass sich nach einer Infektion vor allem die Abwehrzellen vermehren, die besonders gut an die von Viren befallenen Zellstrukturen binden. Man vermutete daher, dass bei einer chronischen Infektion die Zahl dieser hochspezialisierten Killer-Zellen dauerhaft erhöht ist. Die neuen Forschungsergebnisse zeigen jedoch eine Umkehr der Selektion: Je länger die Infektion dauert, desto geringer wird die durchschnittliche Bindungsstärke der T-Zellen.
Blutproben von Menschen und Mäusen untersucht
Um die T-Zell-Antwort im Laufe einer Infektion zu erfassen, analysierte das Team unter der Leitung von Prof. Dirk Busch, Direktor des Instituts für Medizinische Mikrobiologie, Immunologie und Hygiene an der TUM, Blutproben von Menschen, die das Zytomegalievirus in sich tragen. Dieses Virus aus der Familie der Herpesviren ist sehr weit verbreitet. Die meisten Infizierten haben keine Symptome, bei Patientinnen und Patienten mit geschwächtem Immunsystem kann das Virus jedoch unter anderem Entzündungen der Lunge oder Leber auslösen. Da bei Menschen in den meisten Fällen der Zeitpunkt der Infektion nicht bekannt ist, untersuchte das Team außerdem über mehrere Jahre im Labor das Blut von mit dem Zytomegalievirus infizierten Mäusen, bei denen das Datum der Erstinfektion bekannt war.
Geheimnis der umgekehrten Selektion
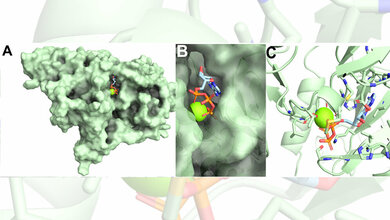
Mit Hilfe eines eigens entwickelten Verfahrens wurden die Abwehrzellen isoliert und analysiert. Jeder Mensch hat viele Millionen unterschiedlicher T-Zellen, an deren Oberflächen sich jeweils ein individueller Proteinkomplex befindet. Die Struktur dieses T-Zell-Rezeptors (TZR) entscheidet darüber, an welche Virusstruktur er andockt und wie fest er dort haftet.
Das Ergebnis der aufwändigen Untersuchung: Direkt nach einer Infektion mit dem Zytomegalievirus dominieren T-Zellen mit stark bindenden Rezeptoren. Einige Zeit später findet man im Blut aber fast nur noch die schwächer bindenden Rezeptoren mit niedrigerer Haftfähigkeit.
Schutz vor überschießender Reaktion?
Über den Nutzen dieser umgekehrten Selektion könne man nur spekulieren, betont Prof. Busch: „Wir vermuten, dass die veränderte Immunreaktion den Organismus vor einer überschießenden Reaktion des Immunsystems schützt.“ Möglicherweise würde eine dauerhafte Ausschüttung von Botenstoffen durch T-Zellen mit hoher Bindungsaffinität starke Entzündungen und damit schädigende Nebenwirkungen hervorrufen.
„Spannend sind die Erkenntnisse vor allem im Hinblick auf die therapeutische Anwendung. T-Zellen werden schon seit über 25 Jahren erfolgreich als lebende Medikamente eingesetzt. Unsere Ergebnisse deuten darauf hin, dass bei chronischen Immunantworten T-Zellen mit weniger stark bindenden Rezeptoren langlebiger sind“, sagt Prof. Busch. Die Ergebnisse könnten künftig helfen, T-Zell-Therapien, die zur Bekämpfung von Infektionserkrankungen und von Tumoren eingesetzt werden, zu verbessern.
Kilian Schober, Florian Voit, Simon Grassmann, et al.: Reverse TCR repertoire evolution toward dominant low-affinity clones during chronic CMV infection. Nature Immunology, 16. März 2020, DOI: 10.1038/s41590-020-0628-2.
Quelle: idw/TUM
Artikel teilen