Wissenschaftler vom Deutschen Konsortium für Translationale Krebsforschung (DKTK), Partnerstandort Technische Universität München, haben nun eine Möglichkeit gefunden, solche immunologisch „kalten“ Pankreastumoren in einem präklinischen Tiermodell in Mäusen durch gezielte Kombination zweier Krebsmedikamente für die Immuntherapie angreifbar zu machen. Die Forscher/-innen vermuten, dass sich der vielversprechende Kombinationsansatz auch bei anderen Tumorarten bewähren könnte.
PDAC fast immer tödlich
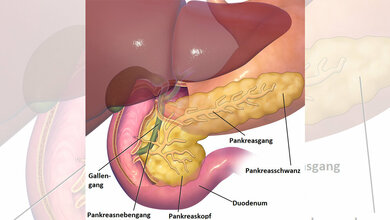
Das duktale Adenokarzinom der Bauchspeicheldrüse (PDAC) ist die weitaus häufigste Form von Pankreaskrebs. Die Krankheit verläuft mit einer 10-Jahres-Überlebensrate von etwa einem Prozent nahezu immer tödlich. Besonders schlecht ist die Prognose bei einer bestimmten Untergruppe des PDAC, dem mesenchymalen Pankreaskarzinom, bei der selbst starke Kombinations-Chemotherapien versagen.
Auch auf moderne Immuntherapien wie Checkpointblockaden spricht das mesenchymale PDAC nicht an. Das liege vermutlich einerseits daran, dass die Tumorzellen wenige Merkmale auf ihrer Oberfläche tragen, die sie für die T-Zellen des Immunsystems als „fremd“ kenntlich machen. Zum zweiten sei die Mikroumgebung des Tumors so beschaffen, dass die therapeutisch aktiven T-Zellen schlicht nicht an den Krebs herankommen. Man spreche daher auch von einem immunologisch „kalten“ Tumor, so die Wissenschaftler.
Mikroumgebung reprogrammieren?
Würde es gelingen, diese Mikroumgebung zu reprogrammieren und damit die T-Zell-Infiltration in den Tumor zu verbessern, so würden sich auch die Erfolgschancen von Immuntherapien erhöhen. Dieser Hypothese sind Wissenschaftler des Deutschen Konsortiums für Translationale Krebsforschung (DKTK), Partnerstandort Technische Universität München (TUM), in einer Reihe verschiedener präklinischer Untersuchungen an humanen Pankreaskarzinomzellen und an Mäusen nachgegangen.
Kein ausreichender Effekt bei Trametinib allein
Vielversprechend schien zunächst der Wirkstoff Trametinib, der erfolgreich bei Krebsarten eingesetzt wird, die eine Aktivierung des RAF-MEK-ERK Signalweges aufweisen. Da dieser bei nahezu allen Pankreaskarzinomen aktiviert ist, lag die Idee nahe, dass die Therapie mit einem Wirkstoff, der diesen Signalweg hemmt, einen therapeutischen Nutzen haben könnte. Untersuchungen ergaben jedoch, dass Trametinib allein noch keinen ausreichenden Effekt zeigt.
Nintedanib in Kombination mit Trametinib
Die Wissenschaftler führten daraufhin an menschlichen PDAC-Zellkulturen sowie Krebszellkulturen aus der Maus ein Hochdurchsatzscreening mit insgesamt 418 verschiedenen Wirkstoffen durch, um herauszufinden, ob eine dieser Substanzen die Wirkung von Trametinib verstärkt. Es stellte sich heraus, dass die bereits für die Behandlung von Lungenkrebs zugelassene Substanz Nintedanib in Kombination mit Trametinib in der Lage war, die T-Zellen zur Infiltration anzuregen. „Beide Wirkstoffe zusammen führten zum Stillstand des Zellzyklus sowie zum Absterben der Krebszellen. Außerdem verändern sie die Mikroumgebung des Tumors“, erklärt Dieter Saur, DKTK-Professor am Partnerstandort an der TU München und Leiter des Instituts für Experimentelle Tumortherapie, den Mechanismus dahinter.
Dreifachbehandlung verbesserte das Ansprechen
Die Wissenschaftler untersuchten nun, ob diese Veränderungen mesenchymale Pankreaskarzinome für die Therapie mit Immuncheckpoint-Inhibitoren sensibilisieren könnten. Dazu führten sie Studien mit transplantierten Mäusen durch, denen Krebszellen bestimmter PDAC-Subtypen übertragen worden waren. „An den Immunreaktionen der Mäuse konnten wir erkennen, dass die Anti-PD-L1-Immuntherapie die Wirkung der Kombinationstherapie mit Trametinib und Nintedanib verstärkt“, sagt Chiara Falcomatá, die Erstautorin der Studie. „Die Dreifachbehandlung verbesserte das Ansprechen des Tumors deutlich und bot einen klaren Überlebensvorteil bei dem hochaggressiven mesenchymalen PDAC-Subtyp.“
Die Ergebnisse sind ein erster, wichtiger Schritt einer zielgerichteten Behandlung des mesenchymalen PDAC, für das es derzeit keine effizienten Therapiemöglichkeiten gibt. Die Forscher vermuten, dass die Kombinationstherapie auch bei anderen Krebsarten eine Anti-Tumor-Immunität auslösen und die therapeutischen Ergebnisse damit verbessern könnte.
Im DKTK verbindet sich das Deutsche Krebsforschungszentrum (DKFZ) in Heidelberg als Kernzentrum langfristig mit onkologisch besonders ausgewiesenen universitären Partnerstandorten in Deutschland.
Quelle: DKFZ
Artikel teilen