Bevor es zum viel zitierten Wunder der Geburt kommt, müssen bereits Monate zuvor zahlreiche Ereignisse stattfinden, die die Wissenschaft bislang noch nicht im Detail verstanden hat. Dazu gehört etwa die Frage, wie eine einzige Zelle den Ursprung für alle weiteren Zellen im künftigen Organismus bilden kann. Zu ergründen, wie das möglich ist, ist das Ziel von Prof. Dr. Maria-Elena Torres-Padilla, Direktorin des Instituts für Epigenetik und Stammzellen (IES) am Helmholtz Zentrum München und Professorin für Stammzellbiologie an der Ludwig-Maximilians-Universität München.
„Uns interessiert vor allem, was passieren muss, damit die Zellen sich so vielfach teilen und in so unterschiedliche Strukturen wie Haut, Leber oder Herz entwickeln können“, erklärt die Forscherin. Dazu untersuchten sie und ihr Team in einer aktuellen Studie das sogenannte Chromatin, also die DNA und die Proteine (Histone) um diese herum. „Wir haben uns angeschaut, wie bestimmte Histone nach der Befruchtung verändert werden und konnten dabei einen neuen Mechanismus aufklären.“**
Kleine Anhängsel, große Auswirkungen
Die Autoren fanden heraus, dass das Molekül Suv4-20h2, eine sogenannte Histon-Methyltransferase, über das Chromatin fährt und kleine chemische Veränderungen (sogenannte Methylgruppen) an die Histone anhängt. Solange das stattfinde, sei die Zelle nur eingeschränkt teilungs- und entwicklungsfähig, erklärt Torres-Padilla. Kommt es aber zur Befruchtung, verschwinden die Anhängsel und die Zelle kann sich zum Organismus weiterentwickeln.
Um diese Ergebnisse zu überprüfen, testeten die Forscher im Versuchsmodell, wie es sich auswirkt, wenn man Suv4-20h2 auch in der befruchteten Eizelle aktiv hält. „Wir konnten zeigen, dass in diesem Fall die Methylgruppen an den Histonen bestehen blieben“, so Erstautor Andre Eid, Doktorand am IES. „Dadurch geriet die Entwicklung ins Stocken und die Zellen kamen über die erste Teilung nicht hinaus.“
In weiteren Experimenten konnte das Team zeigen, dass dieser Mechanismus vermutlich darauf beruht, dass die Methylgruppen an den Histonen zu einem Fehler bei der Verdopplung des Erbmaterials führen und der Zellzyklus zum Erliegen kommt.
„Unsere Ergebnisse geben uns einen Einblick in die komplexen Zusammenhänge zwischen dem Chromatin und der Fähigkeit von Zellen, sich in andere Zelltypen zu entwickeln – die sogenannte Totipotenz“, ordnet Torres-Padilla die Ergebnisse ein. Dies sei sowohl ein wichtiger Schritt für die menschliche Embryologie, als auch für das Verständnis von bestimmten Krebskrankheiten, bei denen die Zellen ganz ähnliche Mechanismen zeigen, die sich auf ihr Wachstum auswirken. (idw, red)
Hintergrundinformationen:
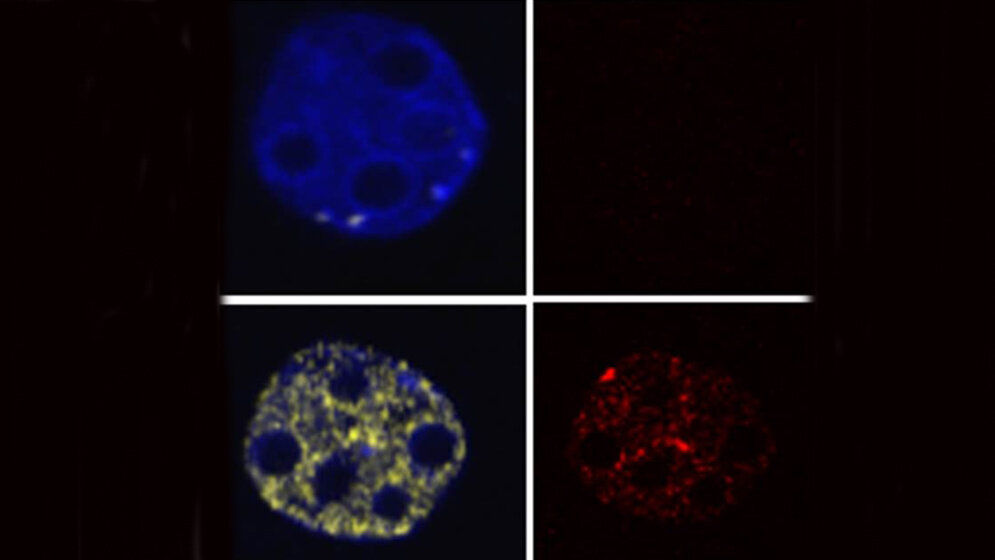
*Während die Zellen ohne Histon-Modifikationen ihre DNA verdoppeln (oben, wenige Zellen in Gelb) und dann zur Zellteilung voranschreiten, verharren die Zellen mit viel Suv4-20 in der Verdopplungsphase (zahlreiche gelbe Zellen) und können sich nicht mehr teilen.
** Konkret zeigten die Forscher, dass Suv4-20h2 für H4K20me3-Methylierungen verantwortlich ist. Anders als bei somatischen Zellen inhibieren diese in den Keimzellen die Zellteilung und die Pluripotenz.
Die Studie ist das Ergebnis eine Kooperation des Helmholtz Zentrums München mit dem Institut de Génétique et de Biologie Moléculaire et Cellulaire (IGBMC) in Straßburg, von wo aus Torres-Padilla an die Isar gewechselt war.
Eid, A. et al. (2016): SUV4-20 activity in the pre-implantation mouse embryo controls timely replication. Genes and Development, DOI: 10.1101/gad.288969.116
Artikel teilen