Zentral in diesem Prozess ist das Enzym Separase. Susanne Hellmuth und Olaf Stemmann vom Lehrstuhl für Genetik an der Universität Bayreuth veröffentlichten bereits in „Nature“ einen Beitrag zur Regulierung dieses Enzyms. Mit ihrer neuen Studie knüpfen sie an diese Ergebnisse an. Nur durch eine strikte Regulierung von Separase während der Zellteilung können gesunde Tochterzellen entstehen. Bei einer verfrühten Aktivierung droht die Entstehung von Krebszellen.
Zelltod durch Separase-Schutzmechanismus
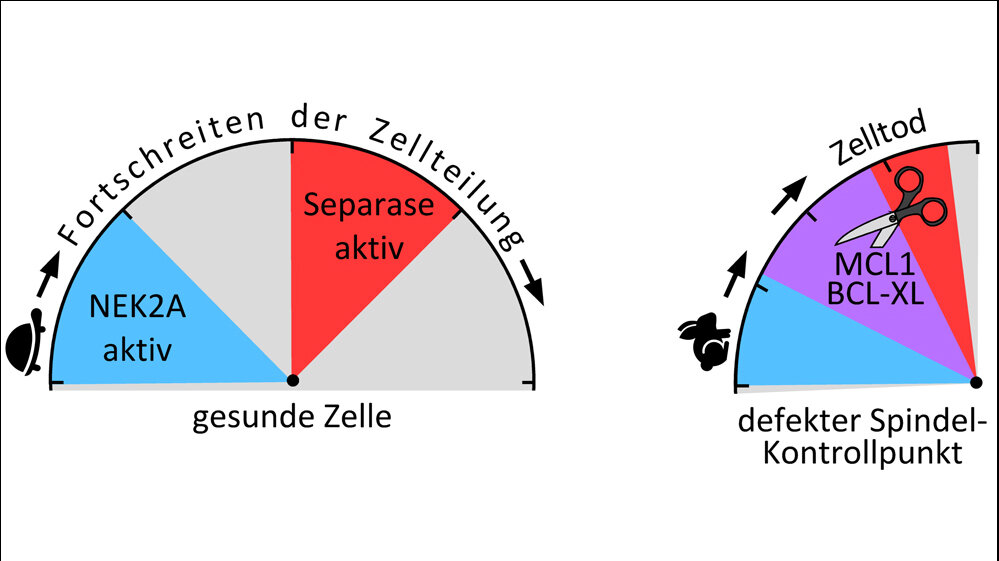
Denn die Separase selbst kann den schwerwiegenden Folgen ihrer verfrühten Aktivierung zuvorkommen, indem sie ein rasches Absterben der sich teilenden Zelle auslöst. Dafür funktioniert sie zwei Eiweiße MCL1 und BCL-XL um, die eigentlich dem Zelltod entgegenwirken sollen. Ist die Zelle gesund, hindern sie im Normalfall gemeinsam das Eiweiß BAK daran, das Absterben der Zelle zu veranlassen. Die frühe Aktivierung von Separase schneidet die Eiweiße auf, sodass sie nicht mehr zellschonend sind und BAK frei wird. Außerdem werden ihre Strukturen durch das Enzym so verändert, dass sie den Zelltod proaktiv fördern und dieser schnell herbeigeführt wird.
Hellmuth und Stemmann fanden zudem einen Mechanismus, der zeigt, dass Separase gesunde Zellen verschont und nur drohende krankhafte Zellen durch die Eiweiße angegriffen werden. Dies ist nach einer Phosphorylierung durch das Enzym NEK2A möglich. Doch im Verlauf der Zellentwicklung wird genau dieses Enzym frühzeitig abgebaut. Bei einem funktionstüchtigen Spindel-Kontrollpunkt ist NEK2A schon vor der Zellteilung verschwunden und Separase arbeitet zum richtigen Zeitpunkt. Ist der Kontrollpunkt allerdings defekt, beschleunigt sich die Zellteilung und Separase wird aktiv, während NEK2A noch in der Zelle ist. So erkennt sie die beiden Eiweiße und leitet den programmierten Zelltod ein.
Die Bayreuther Genetiker bezeichnen diesen Vorgang als „Minimal Duration of Early Mitosis Checkpoint“ (DMC). Es sei ein Notfall-Mechanismus, der in Kraft trete, sobald durch einen defekten Spindel-Kontrollpunkt die Gefahr besteht, dass krankhafte Zellen entstehen.
Gezielte Aktivierung bei neuen Krebstherapien
Durch diese Ergebnisse können neue Ansätze für Krebstherapien entstehen. Denn in Krebszellen werden MCL1 und BCL-XL oftmals in besonders großer Zahl produziert. Doch so schützen sie die Krebszellen und verhindern ihr Absterben. Ein Ansatz könnte nun sein, die Umfunktionierung der Eiweiße durch Separase in diesen Zellen gezielt zu fördern. Genau das wollen Hellmuth und Stemmann künftig mit anderen Forschungsgruppen weiter verfolgen. So sei es bald vielleicht möglich, Krebszellen mit dem zellulären Schutzmechanismus zu zerstören.
Literatur:
Susanne Hellmuth, Olaf Stemmann: Separase-triggered apoptosis enforces minimal length of mitosis. Nature (2020), DOI: https://doi.org/10.1038/s41586-020-2187-y.
Susanne Hellmuth, Laura Gómez-H, Alberto M. Pendás, Olaf Stemmann: Securin-independent regulation of separase by checkpoint-induced shugoshin-Mad2. Nature (2020), DOI: https://doi.org/10.1038/s41586-020-2182-3.
Quelle: Universität Bayreuth
Artikel teilen