Neue „Zielscheibe“ für nebenwirkungsarme Kortisontherapie
Mit über einer halben Million Betroffenen alleine in Deutschland ist die Rheumatoide Arthritis die häufigste chronische Gelenkentzündung. Zur Schmerzlinderung werden Patienten oft viele Jahre mit kortisonhaltigen Medikamenten behandelt. Doch eine solche Langzeittherapie kann schwere Nebenwirkungen haben – von Osteoporose bis Diabetes. Eine Forschergruppe um Professor Jan Tuckermann von der Universität Ulm und Dr. Ulrike Baschant (TU Dresden) hat nun bisher unverstandene molekulare Mechanismen der Kortisonbehandlung aufgedeckt. Ihre veröffentlichten Ergebnisse könnten zu einer gezielteren, nebenwirkungsarmen Behandlung der rheumatischen Erkrankung beitragen.
Kortisontherapie mit möglichen schweren Nebenwirkungen
Das Einkaufen oder Treppensteigen wird zur Qual, und neben schmerzhaften Gelenkentzündungen bis zur -zerstörung sind teilweise auch innere Organe betroffen. Viele Patientinnen und Patienten mit Rheumatoider Arthritis können ihren Alltag während eines Schubs nur mithilfe von kortisonhaltigen Medikamenten meistern. Doch bei jahrelanger entzündungshemmender Kortisontherapie drohen Resistenzen und schwere Nebenwirkungen wie Knochenschwund. Wissenschaftlerinnen und Wissenschaftler haben nun die molekulare Wirkweise von Kortison im Detail nachvollzogen und für die Entzündungshemmung wichtige Zelltypen identifiziert. Das Entwicklungsziel für neue, gezielter wirkende Medikamente: Patienten sollen möglichst ohne gesundheitliche Risiken vom schmerzstillenden Effekt des Arzneistoffs profitieren.
Synoviale Fibroblasten spielen eine Rolle
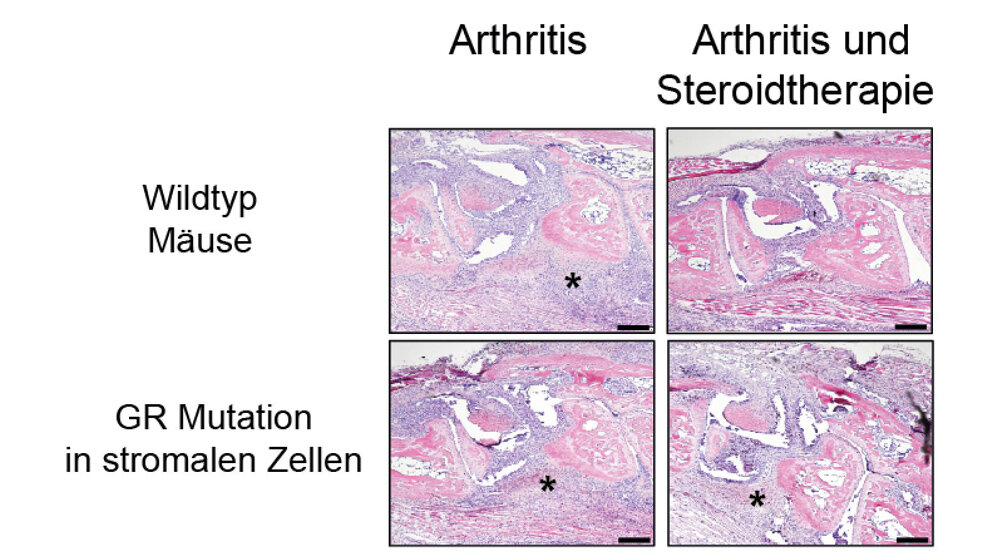
In der Zellkultur und in Mausmodellen mit teils ausgeschaltetem Kortisonrezeptor konnte die Gruppe zeigen, dass so genannte synoviale Fibroblasten eine herausragende, aber indirekte Rolle für die schmerzstillende Kortisontherapie spielen. Dabei handelt es sich um Bindegewebszellen im Gelenkspalt, die sich bei einer Arthritis stark ausbreiten und die Entzündung fördern. Bei einer Behandlung mit Kortison aktivieren diese Fibroblasten vor allem „Fresszellen“ (Makrophagen), die Entzündungsherde beseitigen. Demgegenüber ist die direkt durch den Kortisonrezeptor vermittelte Wirkung des Arzneistoffes auf Immunzellen gering. „Bisher wurde die Wirkung kortisonhaltiger Präparate auf synoviale Fibroblasten lediglich in der Zellkultur untersucht, wodurch sich das Zusammenspiel mit anderen Zellen schwer nachvollziehen lässt. Jetzt konnten wir allerdings erstmals im Mausmodell zeigen, dass gerade die Interaktion der Fibroblasten mit den Fresszellen entscheidend für den Erfolg der antientzündlichen Kortisontherapie ist“, sagt Professor Jan Tuckermann, Leiter des Ulmer Instituts für Molekulare Endokrinologie der Tiere. Außerdem gelang es den Foscherinnen und Forschern, eine „Lehrbuchmeinung“ zu widerlegen: Offenbar spielt die Hemmung „klassischer Zytokine“ – das sind Botenstoffe, die die Immunantwort regulieren – doch keine Schlüsselrolle bei der Arthritis-Behandlung.
Konkrete Verbesserungen für die Rheumatherapie
Aus diesen Ergebnissen aus dem Labor lassen sich konkrete Verbesserungen für die Rheumatherapie ableiten: „Künftige Medikamente sollten entzündungshemmende Wirkstoffe gezielt an Bindegewebszellen im Gelenkspalt, die synovialen Fibroblasten, abgeben oder an Mediatoren, die wir bei RNA-Analysen identifiziert haben“, sagt Mascha Koenen von der Uni Ulm, die Erstautorin der Studie. Werden diese pharmakologischen Zielscheiben direkt anvisiert, könnte die Behandlung rheumatischer Erkrankungen optimiert und Nebenwirkungen reduziert werden. Denn von der chronischen Gelenkentzündung sind längst nicht nur Seniorinnen und Senioren betroffen: Rheumatoide Arthritis kann in jedem Lebensalter auftreten – und gerade bei jüngeren Patienten sollten gesundheitsgefährdende Langzeitfolgen der schmerz- und entzündungshemmenden Therapie verhindert werden.
Die Forschergruppe von den Universitäten Ulm, Dresden, Erlangen-Nürnberg, Lyon I sowie vom Leibniz-Institut für Alternsforschung – Fritz-Lipman-Institut (Jena) wurden durch die Deutsche Forschungsgemeinschaft (Schwerpunktprogramm Immunobone) unterstützt. Weitere Förderer umfassen den Ulmer Trauma-Sonderforschungsbereich 1149, die Boehringer Ingelheim Stiftung, das Trilaterale Consortium für Osteoporose sowie Förderprogramme der Universität Ulm. (idw, red)
Artikel teilen