Tübinger Biochemiker haben einen körpereigenen Mechanismus entdeckt, der die Entstehung gefährlicher Thrombosen verhindern kann. Bislang wurde dieses natürliche Antiblockiersystem für Arterien vor allem an Mäusen untersucht. Erste Untersuchungen mit menschlichen Zellen haben die Ergebnisse bestätigt, sodass sie sehr wahrscheinlich auf Menschen übertragbar sind. Thrombosen zählen weltweit zu den häufigsten Todesursachen, weil sie Blutgefäße verstopfen und damit zu Herzinfarkt oder Schlaganfall führen können. Der neuentdeckte Mechanismus könnte künftig die Therapiemöglichkeiten verbessern. Durchgeführt wurde die Studie von einem Team um Dr. Lai Wen und Professor Robert Feil vom Interfakultären Institut für Biochemie der Universität Tübingen in Zusammenarbeit mit dem Universitätsklinikum Tübingen sowie den Universitäten Lübeck und Würzburg.
Selbstregulierender Mechanismus entdeckt
Wunden schließt unser Körper, indem Blutplättchen die beschädigten Gefäßwände verkleben; das Blut gerinnt. Das geschieht äußerlich, wenn wir uns in den Finger schneiden, aber auch bei kleinen Verletzungen innerhalb von Adern. Letzteres wird zum Problem, wenn das Blutgerinnsel zu groß wird und das Blutgefäß verstopft.
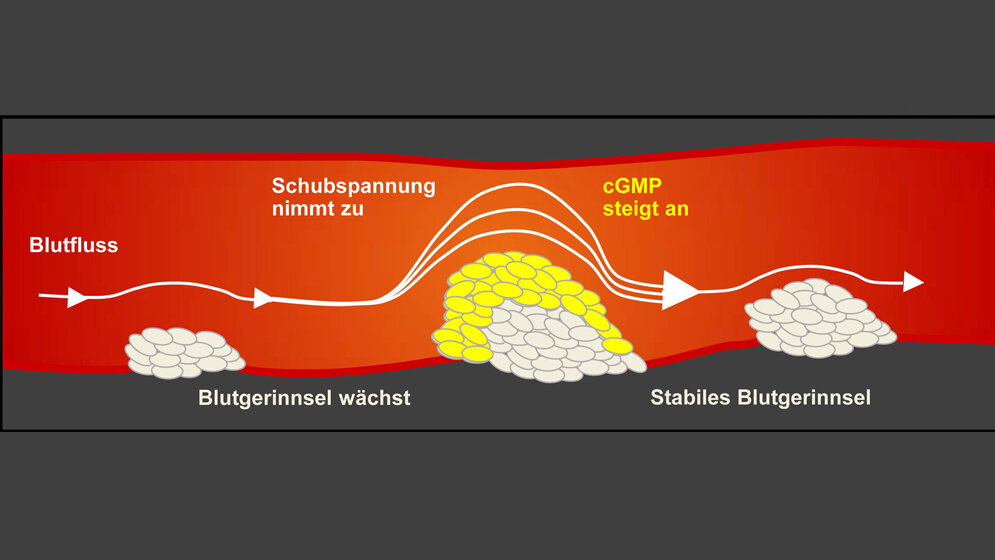
„Wir haben in Blutplättchen von Mäusen und Menschen einen selbstregulierenden Mechanismus entdeckt, der das unkontrollierte Wachstum eines Blutgerinnsels verhindern kann“, erklärt Lai Wen, der Erstautor der Studie: Wenn ein Blutgerinnsel wachse, müsse das Blut das Hindernis umfließen. Je größer das Gerinnsel, desto mehr Kraft übe das vorbeiströmende Blut darauf aus: die sogenannte Schubspannung steige. Das setze einen Mechanismus in Gang, der bewirke, dass in den verklebten Blutplättchen mehr cyclisches Guanosinmonophosphat (cGMP) gebildet werde. „Dieser Botenstoff verhindert, dass weitere Blutplättchen haften bleiben und das lebensbedrohliche Gerinnsel löst sich langsam auf“, beschreibt Wen. Fließe das Blut wieder ungehindert, sinke die Schubspannung und der Mechanismus stoppe. Ein kleines Gerinnsel bleibe bestehen und verschließe weiterhin die Verletzung in der Gefäßwand. Das cGMP wirke somit als eine Art Antiblockiersystem für Blutgefäße, das sich je nach Bedarf über die Schubspannung selbst ein- oder ausschalte.
Neue Möglichkeiten bei der Therapie von Thrombosen?
„Studien haben gezeigt, dass Menschen, die aufgrund eines genetischen Defekts weniger cGMP bilden, häufiger einen Herzinfarkt erleiden – der neuentdeckte Mechanismus wäre eine Erklärung dafür“, erläutert Feil. Die Entdeckung des cGMP Antiblockiersystems lasse aber nicht nur besser verstehen, wie Herzinfarkte entstehen; sie eröffne auch neue Möglichkeiten bei der Therapie von Thrombosen. Es gebe bereits Medikamente, die den Körper bei der Bildung von cGMP unterstützen. „Sie wurden für andere Zwecke entwickelt, könnten aber möglicherweise auch zur Behandlung bei Thrombosegefahr eingesetzt werden“, sagt Feil. Dazu gehörten beispielsweise Präparate mit den Wirkstoffen Riociguat oder Sildenafil; letzteres wird oft in Potenzmitteln eingesetzt.
„Herkömmliche Medikamente gegen Thrombosen verursachen häufig Blutungen, weil sie die Blutgerinnung im gesamten Körper hemmen. Medikamente, die am cGMP-Mechanismus ansetzen, sollten dagegen weniger lebensgefährliche Nebenwirkungen haben“, erläutert Feil. Sie wirken nur bei erhöhter Schubspannung und die gebe es außerhalb von Blutgefäßen nicht. Um dies endgültig für den menschlichen Körper zu bestätigen, müssen jedoch noch klinische Studien folgen. „Darüber hinaus könnte das Zusammenspiel von mechanischer Krafteinwirkung auf Zellen und der Bildung von cGMP auch bei vielen anderen Krankheiten eine Rolle spielen“, vermutet Feil. „Interessante Aspekte für künftige Forschungen sind beispielsweise die Auswirkungen des neuentdeckten Mechanismus auf Blutdruck, Osteoporose oder Krebs.“ (idw, red)
Lai Wen, Susanne Feil, Markus Wolters, Martin Thunemann, Frank Regler, Kjestine Schmidt, Andreas Friebe, Marcus Olbrich, Harald Langer, Meinrad Gawaz, Cor de Wit, Robert Feil: A shear-dependent NO-cGMP-cGKI cascade in platelets acts as an auto-regulatory brake of thrombosis. Nature Communications. DOI: 10.1038/s41467-018-06638-8.
Artikel teilen