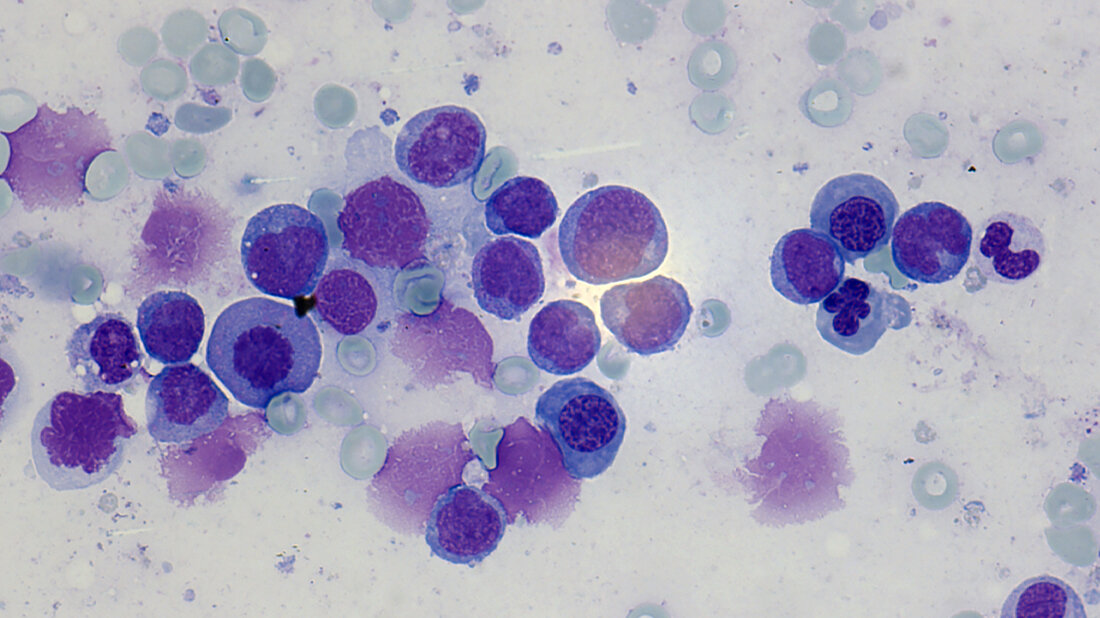
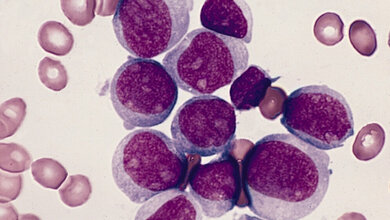
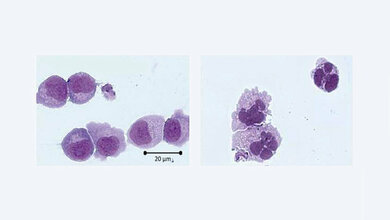
Die akute myeloische Leukämie (AML) ist eine bösartige Erkrankung des blutbildenden Systems, die von unreifen Vorstufen der roten Blutkörperchen, Blutplättchen und einem Teil der weißen Blutkörperchen ausgeht. Es handelt sich um eine biologisch heterogene Erkrankung, die unbehandelt in kurzer Zeit zum Tod führt. Während bei gesunden Menschen die Vermehrung und Erneuerung der Blutzellen strikt reguliert ist, gerät dieser Prozess bei der AML außer Kontrolle: Eine frühe Vorstufe der sogenannten myeloischen Zellen entartet und vermehrt sich unkontrolliert. Sie breiten sich rasch im Knochenmark aus, verhindern dort die Bildung gesunder Blutbestandteile und beeinträchtigen schließlich lebensnotwendige Funktionen des blutbildenden Systems. Die Krankheitsursachen sind bislang nur unvollständig erforscht und können mit verschiedenen genetischen Veränderungen zusammenhängen, die teilweise im Laufe des Lebens erworben werden. Die AML ist mit etwa 80 Prozent der Fälle zwar die häufigste Form der akuten Leukämie im Erwachsenenalter, aber mit rund drei neuen Fällen pro 100.000 Menschen im Jahr eine seltene Erkrankung. Die Inzidenz steigt mit dem Alter. Die altersspezifischen Inzidenzen werden mit über 100 Fällen pro 100.000 Einwohner bei Patientinnen und Patienten im Alter über 70 Jahre angegeben. Gleichzeitig verschlechtert sich mit steigendem Alter die Prognose für Patientinnen und Patienten und die Gefahr von Rückfällen und Behandlungsresistenzen steigt.
Untersuchung der IDH1-Mutation
Ein Forschungsteam der Medizinischen Fakultät der Christian-Albrechts-Universität zu Kiel (CAU) und der Klinik für Innere Medizin II, Hämatologie und Onkologie, des Universitätsklinikums Schleswig-Holstein (UKSH), Campus Kiel, hat nun eine auch aus der Hirntumorforschung bekannte Genmutation auf eine mögliche Beteilung am Fortschreiten und der Verschlechterung der Prognose mit steigendem Alter untersucht. Diese sogenannte IDH1-Mutation tritt ab dem 65. Lebensjahr signifikant häufiger auf, was aus umfangreichen Genom-Daten von AML-Betroffenen hervorgeht. Grundsätzlich steht die Mutation mit der Bildung eines bestimmten Stoffwechselproteins in Verbindung, das in die Zelldifferenzierung und damit Reifung der Blutzellen eingreift. Die Forscherinnen und Forscher konnten nun jedoch einen für diese Leukämieform bislang unbekannten Mechanismus beschreiben, der für eine fehlerhafte räumliche Anordnung der DNA-Struktur sorgt und darüber die Aktivierung eines bestimmten krebsfördernden Gens verursacht. Ihre Ergebnisse veröffentlichten die Wissenschaftlerinnen und Wissenschaftler um Professorin Claudia Baldus vom Kieler Krebsforschungsnetzwerk „Kiel Oncology Network“ (KON) und dem Universitären Cancer Center Schleswig-Holstein (UCCSH) gemeinsam mit Partnerinstitutionen kürzlich.
Auswirkungen der Hypermethylierung
Bei der Entstehung von Krebserkrankungen wirken häufig eine Vielzahl unterschiedlicher Faktoren zusammen. Wissenschaftlerinnen und Wissenschaftler suchen daher nach genetischen Mustern, die die Aktivierung bestimmter krebsrelevanter Gene erklären können. Aus vorausgegangenen Forschungsarbeiten ist bereits bekannt, dass die sogenannte IDH1-Mutation mit einer genomweit erhöhten Methylierung der DNA in Verbindung steht. Unter Methylierung versteht man die chemische Veränderung der DNA, die bei gesunden Menschen bestimmte Gene zielgerichtet an- oder ausschaltet und somit die Menge der daraus gebildeten Proteine reguliert. Ist die DNA-Methylierung erhöht, spricht man von einer Hypermethylierung. Betrifft dies nun Gene, die für die Zelldifferenzierung zu fertigen Blutzellen verantwortlich sind, können diese nicht korrekt aktiviert werden und die betroffenen Zellen teilen sich immer weiter anstatt zu differenzieren. Die Folge ist ein schnelleres Voranschreiten der Erkrankung. Darüber hinaus liefern neue Ergebnisse aus der Hirntumorforschung nun Hinweise darauf, dass die Hypermethylierung auch eine veränderte räumliche Struktur der DNA im Zellkern bewirken kann und dass dies bei Patientinnen und Patienten mit Gehirntumoren mit IDH1-Mutation zu einer Aktivierung krebsrelevanter Gene führen kann.
Hochregulierung des Gens PDGFRA
In der neuen Forschungsarbeit, die von der José Carreras Leukämie-Stiftung unterstützt wurde, untersuchten die Kieler Wissenschaftlerinnen und Wissenschaftler, ob diese 3-D-Veränderungen der DNA auch bei der Leukämie-Entstehung eine Rolle spielen. „Wir haben festgestellt, dass die Hypermethylierung nicht nur bekannte Differenzierungsgene betrifft, sondern auch an Bindestellen für sogenannte CTCF-Bindeproteine auftreten kann. Normalerweise geben diese Bindestellen vor, auf welche Weise sich die DNA räumlich anordnet, indem benachbarte Bindeproteine DNA-Schleifen abschnüren, die dann bestimmte Gene von anderen Erbinformationen isolieren“, sagt Dr. Sophie Steinhäuser, wissenschaftliche Mitarbeiterin in der Arbeitsgruppe Funktionelle Genomik Akuter Leukämien. „Durch die fehlerhafte Methylierung an solchen Bindestellen können die Schleifen aber nicht richtig gebildet werden und die eigentlich darin isolierten Gene kommen mit aktivierenden Elementen außerhalb in Kontakt und werden aktiviert“, so Steinhäuser weiter. Bei den AML-Patientinnen und Patienten mit der IDH1-Mutation bewirkt dies eine Hochregulierung eines Gens, PDGFRA, das zur Familie der Tyrosinkinasen gehört. Diese Enzyme sind Teil des zellulären Rezeptorsystems und übermitteln unter anderem Signale des Zellwachstums, wodurch sie auch im Zusammenhang mit Krebs eine wichtige Rolle spielen. So steht die Hochregulierung von PDGFRA in der AML mit IDH1-Mutation tatsächlich mit einer Verschlechterung der Prognose in Verbindung.
Untersuchung im Zellmodell
Um einen Zusammenhang zwischen der Aktivierung des PDGRFA-Gens und einer veränderten räumlichen Anordnung der DNA herzustellen, haben die Forscherinnen und Forscher mit einem sogenannten Zellmodell gearbeitet. Dabei haben sie durch sogenanntes Genome Editing Blutkrebs-Zellen generiert, die eine IDH1-Mutation aufweisen und konnten beobachten, dass das krebsrelevante Gen in diesen künstlichen Zellen ebenfalls vermehrt vorhanden ist. „Anschließend haben wir in unserem Zellmodel die Methylierung der DNA untersucht und belegen können, dass eine der Bindestellen, die das PDGFRA-Gen umschließen, in den mutierten Zellen tatsächlich methyliert ist und die Isolierung des Gens damit gehemmt ist“, betont Steinhäuser. Darin sehen die Forscherinnen und Forscher eine Bestätigung, dass dieser Mechanismus für das krebsfördernde Potenzial der IDH1-Mutation eine Rolle spielt, die bisher noch nicht bekannt war.
Potenzielle Behandlungsansätze bei AML mit IDH1-Mutationen
Mit der Identifizierung dieser Zusammenhänge haben die Forscherinnen und Forscher einen Ansatz gefunden, der sich möglicherweise für künftige Behandlungsformen nutzen lässt. Tyrosinkinasen lassen sich prinzipiell mit Inhibitoren hemmen, diese Möglichkeit wird auch bei anderen Krebserkrankungen genutzt, um unkontrolliertes Zellwachstum zu unterdrücken. „In verschiedenen Experimenten haben wir ein bereits zugelassenes Medikament zur Tyrosinkinase-Inhibition auch an Leukämie-Zellen mit IDH1-Mutation erprobt“, erklärt Baldus, Direktorin der Klinik für Innere Medizin II und Vorstand des Universitären Cancer Center Schleswig-Holstein (UCCSH) und Leiterin der Arbeitsgruppe Funktionelle Genomik Akuter Leukämien an der Medizinischen Fakultät der CAU. „Sowohl im künstlichen Zellmodell als auch in in-vivo Studien mit Versuchstieren zeigte sich, dass der Wirkstoff eine Reduktion von Leukämiezellen in Blut, Knochenmark und Milz hervorrief. Damit besteht ein potenziell vielversprechender Ansatz, der künftig für eine spezifischere Behandlung der AML im Zusammenhang mit der IDH1-Mutation in Betracht kommen könnte“, sagt Baldus. In künftigen Forschungsarbeiten wollen die Wissenschaftlerinnen und Wissenschaftler diesen Ansätzen weiter nachgehen, um auch die mit steigendem Alter besonders gefährdete Gruppe von AML-Patientinnen und Patienten künftig zielgerichteter und erfolgreicher behandeln zu können.
Quelle: idw/CAU
Artikel teilen