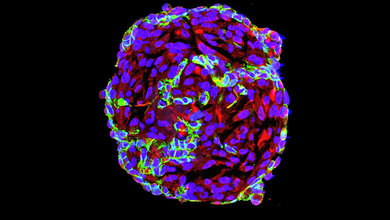
Vor knapp zehn Jahren machten Forscherinnen und Forscher erstmals die Beobachtung, dass Tumore verschiedener Krebsarten wie Darmkrebs, Brustkrebs oder schwarzer Hautkrebs Kanäle aufweisen, die von der Oberfläche ins Innere des Zellhaufens führen. Wie entstehen diese Kanäle und welche Funktionen üben sie aus? Die Antworten blieben lange im Verborgenen. Nun haben die Forschungsgruppen um Viola Vogel, Professorin für angewandte Mechanobiologie an der ETH Zürich, und um Gertraud Orend von der Université Strasbourg mit aufwändigen und detaillierten Untersuchungen bei Mäusen mit Brustkrebs mögliche Antworten auf diese Fragen gefunden: Vieles deute darauf hin, dass die als „tumor tracks“ bezeichneten Kanäle von Blutgefäßen abstammen, so die Wissenschaftlerinnen und Wissenschaftler.
Tumore brauchen gute Versorgung
Zu Beginn versorgen Blutgefäße den rasch wachsenden Zellhaufen mit Zucker und Sauerstoff. Doch dann durchlaufen die Gefäße laut der Forscher einen Prozess, während dessen sie ihre ursprüngliche bluttransportierende Funktion verlieren, weil sich die Gefäßwand verändere und sich der Gefäßhohlraum allmählich ausfülle. Das Füllmaterial bestehe vor allem aus Zellen und neu gemachten Proteinfasern, die zur sogenannten extrazellulären Matrix gehören. Neben Kollagenfasern finden sich auch Fasern aus Fibronektin. Sie sind eigentlich an Wachstumsprozessen beteiligt, die sich überwiegend während der Embryonalentwicklung oder der Wundheilung abspielen. In den in Tumorkanäle umgewandelten Blutgefäßen seien die Fasern in der Lage, Immunzellen festzuhalten, wie die Forscherinnen und Forscher aufzeigen.
„Hilfe“ für die Krebszellen
Denn die Zellen strecken sich entlang der Kanäle und haften an den losen Fibronektin-Fasern. „In dieser langgezogenen Form beteiligen sich die Immunzellen nicht am Abwehrkampf, sondern unterstützen Heilungsprozesse“, sagt Vogel. Anstatt sich gegen die Tumorzellen zu richten, scheiden die Immunzellen wachstumsfördernde Moleküle aus – und helfen so den Krebszellen, sich zu vermehren. Offenbar spiele die von der extrazellulären Matrix vermittelte Gewebespannung eine wichtige und bisher nicht bekannte Rolle in der Entwicklung eines Tumors, denn die Fibronektin-Fasern seien im gesunden Gewebe stark gestreckt – und nur im Tumorgewebe schlaff. In dieser lockeren, entspannten Form, umgeben von transformierten Gefäßwänden, schaffen die Fibronektin-Fasern offenbar eine Nische, in der die Krebszellen ungestört wachsen können.
Extrazelluläre Matrix bisher vernachlässigt
Bisher seien meist die Zellen im Fokus der Krebsforschung gestanden, meint Vogel. „Die extrazelluläre Matrix wurde vernachlässigt.“ Dadurch sei unentdeckt geblieben, wie die Umgebung Zellfunktionen steuert. „Aber wenn man verstehen will, wie eine Spinne funktioniert, muss man auch ihr Netz berücksichtigen“, sagt die Biophysikerin. Die neuen Erkenntnisse versteht Vogel deshalb auch als Denkanstoß, um den Blickwinkel zu erweitern – und so das Verständnis zu verfeinern. „Denn je besser wir verstehen, was Tumorzellen brauchen, um sich zu vermehren, desto eher finden wir auch Möglichkeiten, wie wir diese Vermehrung verhindern können“, sagt Vogel.
Übertragung auf den Menschen?
Sie gibt allerdings zu bedenken, dass die Resultate aus Versuchen an Mäusen mit Brustkrebs stammen. Ob sie sich direkt auf das Krebsgeschehen im Menschen übertragen lassen, sei zum jetzigen Zeitpunkt noch nicht klar. Allerdings gebe es einige Parallelen, wie die Gruppe um Orend kürzlich mit einer anderen Studie aufzeigt habe. Derweil hat die Forschungsgruppe von Vogel eine Zusammenarbeit mit dem Kantonsspital Baden begonnen: Einer ihrer Doktoranden untersucht in einem Folgeprojekt, ob sich auch in Gewebeproben von Brustkrebspatientinnen Spuren von umgewandelten Blutgefäßen finden lassen. „Wo finden wir Analogien – und wo Unterschiede?“, fragt Vogel.
Quelle: idw/ETH
Artikel teilen