Die Arme und Beine zittern unaufhörlich, die Muskeln werden zunehmend schwächer und die Bewegungen langsamer – all dies sind typische Symptome, unter denen viele Parkinson-Patienten leiden. Weltweit sind es über sechs Millionen Menschen. Bei den Betroffenen sterben im Gehirn die Dopamin-bildenden Nervenzellen langsam ab. Der daraus resultierende Mangel an diesem Botenstoff beeinträchtigt die Motorik und oft auch die kognitiven Fähigkeiten.
Sind Proteinfibrillen die Verursacher?
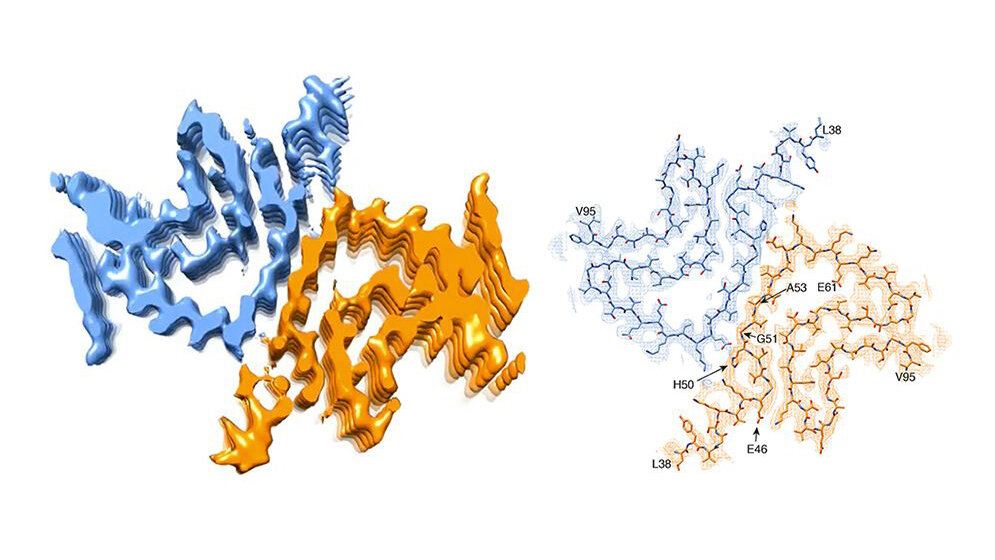
Bislang nahm man an, dass einer der Auslöser das Eiweiß alpha-Synuclein sei. Es kann verklumpen und lagert sich als Lewy-Körperchen in den Nervenzellen ab. Die toxischen Proteinfasern richten die Zellen im Gehirn zugrunde. Ein Forscherteam unter der Leitung von Prof. Henning Stahlberg vom Biozentrum der Universität Basel hat in Zusammenarbeit mit Forschern von Hoffmann-La Roche Ltd. und der ETH Zürich so eine alpha-Synuclein-Fibrille nun künstlich im Reagenzgefäss erzeugt und erstmals mit atomarer Auflösung sichtbar machen können. „Entgegen unseren Erwartungen werfen die Ergebnisse allerdings mehr Fragen auf, als sie beantworten“, so Stahlberg.
Dazu muss man wissen, dass bei einigen angeborenen Formen von Parkinson die Betroffenen genetische Defekte im alpha-Synuclein-Gen haben. Die Mutationen, so vermutet man, führen schließlich dazu, dass sich das Protein falsch faltet und sich zu den gefährlichen Fibrillen zusammenlagert. „Unsere 3-D-Struktur zeigt jedoch eine Fibrillen-Struktur, welche mit einem derart mutierten Protein gar nicht gebildet werden könnte“, sagt Stahlberg. „Aufgrund ihrer Lage würden die meisten dieser Mutationen die Bildung der von uns gefundenen Fibrillen-Struktur eher behindern.“ Kurz gesagt: Wenn diese Fibrillen-Struktur Parkinson auslösen sollte, müsste der Gen-Defekt vor der Krankheit schützen. Dies tut er jedoch nicht. Es könnte sein, dass eine andere Form von Fibrillen oder eine andere Form des Proteins die Krankheit bei diesen Patienten auslöst.
Studie wirft neue Fragen auf
Was die Mutationen im alpha-Synuclein bewirken, ob sich andere Formen von Proteinaggregaten herausbilden, welche Rolle die Fibrillen für die Nervenzellen spielen und woran die Nervenzellen letztlich sterben – diesen Fragen muss nun nachgegangen werden. Bis heute ist die genaue Funktion von alpha-Synuclein nicht klar. Da sich mit den bisherigen Medikamenten nur die Beschwerden lindern lassen, sind dringend neue Konzepte gefragt. (Uni Basel)
Ricardo Guerrero-Ferreira, Nicholas M.I. Taylor, Daniel Mona, Philippe Ringler, Matthias E. Lauer, Roland Riek, Markus Britschgi, and Henning Stahlberg: Cryo-EM structure of alpha-synuclein fibrils. eLife, publiziert online 3. Juli 2018, DOI: 10.7554/eLife.36402.
Artikel teilen