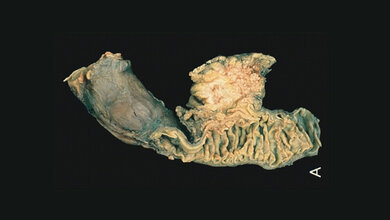
Befinden sich Zellen in einem Gewebe oder Tumor, bilden sie Kontakte zu anderen Zellen aus und haben eine pflastersteinartige Form. Krebszellen, die Metastasen bilden, müssen zuerst ihre Form und Eigenschaften verändern. Sie müssen ihren Stoffwechsel umstellen und sich aus dem Zellverband des Tumors lösen können. Sie werden dadurch schmal und länglich und gelangen in angrenzende Blutgefäße. Das Blut nutzen sie als Transportmittel, um andere Organe zu erreichen und ihr Gewebe zu befallen.
Dazu ist aber erneut eine Veränderung notwendig. Die Zellen müssen wieder Kontakt zu anderen Zellen ausbilden können, um sich gewissermaßen an ihnen „festzuhalten“. Nicht alle Krebszellen besitzen diese Wandelbarkeit, die sogenannte Plastizität. Dr. Maximilian Reichert, Erstautor der neuen Studie und Forschungsgruppenleiter in der Klinik und Poliklinik für Innere Medizin II am TUM Universitätsklinikum rechts der Isar, hat herausgefunden, warum das so ist und welche Folgen das für die Ausbreitung von Bauchspeicheldrüsentumoren hat.
Leber oder Lunge – was ist entscheidend?
„Wir konnten zeigen, dass vor allem das Befallen der Leber von der Plastizität der Tumorzelle abhängt. Kann die Zelle keine Zell-Zell-Kontakte ausbilden, so wird sie mit dem Blutstrom passiv weiter in die Lunge gespült, wo sie hängen bleibt“, erklärt Reichert und ergänzt: „Für Patienten ist dieser Verlauf günstiger, da Lungentumore besser kontrollierbar sind.“
Entscheidend für die Wandelbarkeit einer Tumorzelle ist ein molekularer „Kleber“: das Protein E-Cadherin. Es sitzt auf der Zelloberfläche und ist für Zell-Zell-Kontakte verantwortlich. Das Forschungsteam entdeckte in einem Mausmodell, dass die Abwesenheit von E-Cadherin dazu führt, dass Tumorzellen aus dem Bauchspeicheldrüsenkrebs nur in die Lunge ‚streuen‘, nicht aber in die Leber.
War das Protein vorhanden und funktionsfähig, so konnten die Tumorzellen auch in die Leber eindringen. Grund hierfür ist, laut der Forscherinnen und Forscher, dass sich die Krebszellen über den engen Zell-Zell-Kontakt durch E-Cadherin im Lebergewebe verankern und so das Organ auch befallen können. Das Forschungsteam war in der Lage die Anwesenheit von E-Cadherin zu verändern und somit die Metastasierung in den Tieren zu steuern.
Epigenetische Faktoren als Ursache
Im Tumor werden diese Mechanismen offenbar über so genannte epigenetische Programme gelenkt, wie das Forschungsteam herausfand. Hierbei wird unser Erbgut – die DNA – nicht selbst verändert, sondern chemische Faktoren beeinflussen, wie stark oder schwach ein Abschnitt der DNA abgelesen wird.
Gemeinsam mit Kolleginnen und Kollegen am Klinikum rechts der Isar wird das Team um Maximilian Reichert künftig untersuchen, ob sich diese epigenetischen Programme hemmen lassen oder als Angriffspunkt für Therapien eignen. „Je besser wir die Bildung von Metastasen verstehen, umso eher können wir sie beeinflussen. Gerade beim Bauchspeicheldrüsenkrebs wäre das wichtig, denn fast alle Patienten sterben an den Metastasen“, sagt Reichert. (idw, red)
Maximilian Reichert, Basil Bakir, Leticia Moreira, et al.: Regulation of Epithelial Plasticity Determines Metastatic Organotropism in Pancreatic Cancer. Developmental Cell Vol. 45 Iss. 6, June 18, 2018, DOI: 10.1016/j.devcel.2018.05.025.
Artikel teilen