Bei der gemeinschaftlichen Studie haben zusammengearbeitet: Universität Bonn, das Deutsche Zentrum für Neurodegenerative Erkrankungen (DZNE), die University of Massachusetts (USA) und das Institut François Jacob in Frankreich. Das Protein Alpha-Synuclein (abgekürzt aSyn) erfüllt in den Nervenzellen des Gehirns wichtige Aufgaben. Unter bestimmten Umständen können aSyn-Moleküle jedoch miteinander verklumpen und unlösliche Aggregate bilden. Diese schädigen die Neuronen; man findet sie zum Beispiel typischerweise im Gehirn von Parkinson-Erkrankten oder von Betroffenen mit Lewy-Körperchen-Demenz.
Mikrogliazellen können zugrunde gehen
Daher versuchen die Immunzellen des Gehirns, die Mikrogliazellen, die aSyn-Aggregate abzubauen und zu entsorgen. Dieser Prozess ist nicht nur zeitaufwändig; er kann auch dazu führen, dass die Mikrogliazellen selbst zugrunde gehen. „Wir haben nun einen Mechanismus identifiziert, der beide Probleme adressiert“, erklärt Prof. Dr. Michael Heneka. Der Wissenschaftler ist Direktor der Klinik für Neurodegenerative Erkrankungen und Gerontopsychiatrie am Universitätsklinikum Bonn und forscht dort sowie am DNZE zu neurodegenerativen Krankheiten wie Parkinson und Alzheimer.
Arbeitsteilung verhindert Überlastung
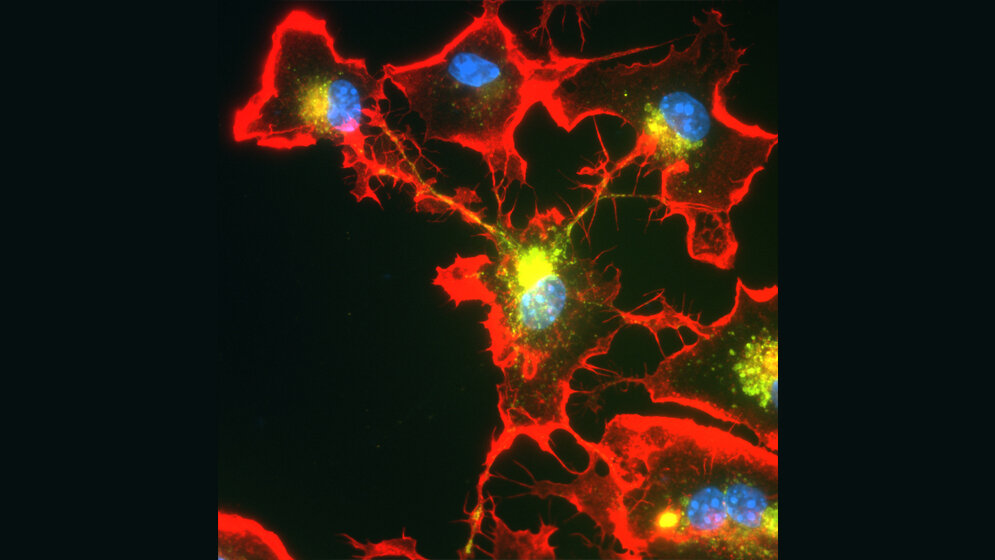
Demnach können sich die Mikrogliazellen spontan zusammenschließen, um der Gefahr besser Herr zu werden. Sie bilden dazu schlauchähnliche Fortsätze, die an benachbarte Mikrogliazellen andocken. Durch diese Verbindungen werden die aSyn-Aggregate dann unter den Partnern des Netzwerks verteilt. Ohne diese Arbeitsteilung müssten einzelne Immunzellen einen Hauptteil der Abbauarbeit schultern und würden überlastet.
Der Zusammenschluss verhindere das. Die Verbindungsschläuche erfüllen aber auch noch einen weiteren Zweck: Über sie können Mikrogliazellen ihre Nachbarn „aufpäppeln“, wenn diese zu stark in Bedrängnis oder gar in „Lebensgefahr“ geraten. „Sie verschicken dann Mitochondrien an die Nachbarzellen, die gerade mit dem Abbau der Aggregate beschäftigt sind“, erklärt Henekas Mitarbeiterin Dr. Hannah Scheiblich. „Mitochondrien funktionieren wie kleine Kraftwerke; sie liefern den bedrängten Zellen also zusätzliche Energie.“
Transport von aSyn durch die Verbindungsschläuche beeinträchtigt
Bei bestimmten Mutationen, die sich gehäuft bei Parkinsonkranken finden, ist sowohl der Transport des aSyns als auch der Mitochondrien beeinträchtigt. Ähnliches trifft auch auf eine andere Erkrankung zu, bei der der Abbau von aSyn gestört ist: der Lewy-Körperchen-Demenz. Die Forschenden haben aus Blutproben von Betroffenen bestimmte Immunzellen isoliert, die Makrophagen. Diese lassen sich mit Hilfe spezifischer Steuerungsmoleküle in Mikroglia-ähnliche Zellen umwandeln. „Diese konnten sich im Labor zwar noch vernetzen. Der Transport von aSyn durch die Verbindungsschläuche war jedoch stark beeinträchtigt“, sagt Heneka, der auch Mitglied des Exzellenzclusters Immunosensation2 und des transdisziplinären Forschungsbereichs „Leben & Gesundheit“ ist.
Öffnet Befund neue therapeutische Perspektiven?
Dass sich Mikrogliazellen zusammenschließen können, war bislang nicht bekannt. „Wir haben die Tür zu einem Feld aufgestoßen, das die Forschung sicher noch viele Jahre beschäftigen wird“, betont Heneka. Möglicherweise eröffnen sich damit mittelfristig auch neue therapeutische Perspektiven für neurologische Störungen wie Parkinson oder auch Demenz-Erkrankungen.
Hannah Scheiblich, Cira Dansokho, Dilek Mercan, et al.: Microglia jointly degrade fibrillar alpha-synuclein cargo by distribution through tunneling nanotubes. Cell, DOI: 10.1016/j.cell.2021.09.007.
Quelle: idw/Rheinische Friedrich-Wilhelms-Universität Bonn
Artikel teilen