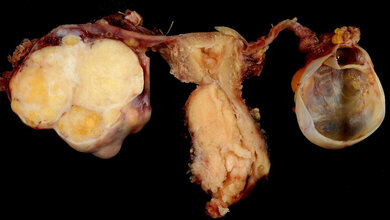
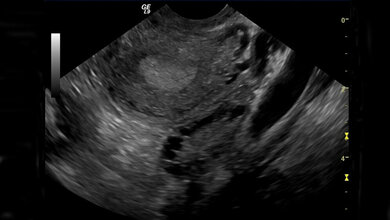
Eine Forschungs-Allianz des Zentrums für Tumor- und Immunbiologie (ZTI) sowie der Klinik für Gynäkologie der Philipps-Universität Marburg liefern möglicherweise eine neue Basis für die Therapie des Eierstock-Krebs. Sie entdeckten ein Kommunikations-Netzwerk zwischen Tumor- und Immunzellen, welches über die Ausschüttung von Signal-Proteinen Tumorzellen aggressiver macht und Immunzellen hemmt. Diese Erkenntnisse sind eine vielversprechende Grundlage für die Entwicklung innovativer Wirkstoffe und neuer therapeutischer Prinzipien.
Der Eierstockkrebs ist eine aggressive Tumorerkrankung, die in der Regel erst im Spätstadium entdeckt wird. Bei Frauen ist er die fünfthäufigste krebsbedingte Todesursache. Neue Therapieoptionen sind daher dringend notwendig.
Protein fördert Tumor-Wachstum – Hemmstoff in präklinischer Studie
Im Rahmen eines von der Wilhelm Sander-Stiftung mit rund 360.000 Euro über vier Jahre geförderten Projektes machten Privatdozentin Dr. Sabine Müller-Brüsselbach, Leiterin am Marburger Institut für Molekularbiologie und Tumorforschung (IMT) gemeinsam mit Dr. Silke Reinartz und Prof. Dr. Uwe Wagner, Marburger Klinik für Gynäkologie, eine wichtige Entdeckung: „Wir konnten nachweisen, dass ein das Tumorwachstum förderndes Protein durch bestimmte Fettsäuren im Bauchwasser der Patientinnen aktiviert wird“, erklärt Müller-Brüsselbach einen bedeutenden Befund. Demnach gelange der Aktivator für den Rezeptor „PPARβ/δ“ aus dem für diese Krebs-Form typischen Bauchwasser (Aszites) durch die Zellmembranen in den Zellkern. Dort aktiviere er bestimmte Gene, die zur Ausbreitung von Tumorzellen beitragen könnten. Dabei spielten nicht nur Tumorzellen, sondern auch durch den Tumor umprogrammierte Immunzellen eine entscheidende Rolle.
Von besonderer Bedeutung ist noch ein weiteres Ergebnis: Die Forscher konnten zeigen, dass ein gemeinsam mit dem Team von Prof. Dr. Wibke Diederich, Marburger Institut für Pharmazeutische Chemie, entwickelter Hemmstoff die Aktivierung von PPARβ/δ blockiert. Der Hemmstoff soll nun in präklinischen Studien weiter untersucht werden.
Wie Tumor- und Immunzellen miteinander sprechen
Darüber hinaus konnte im Rahmen des Förder-Projektes ein umfangreiches Kommunikations-Netzwerk zwischen Tumor- und Immunzellen im Aszites aufgedeckt werden. Dabei spielen zahlreiche von diesen Zellen ausgeschüttete Moleküle eine entscheidende Rolle. Diese Moleküle docken nach ihrer Freisetzung an andere Zellen an und beeinflussen deren Funktion; so können sich Tumorzellen etwa verstärkt ausbreiten, werden gegen Chemotherapeutika resistent oder hemmen die Immunabwehr. Besonders wichtig: Die Forscher stellten für einige dieser Moleküle auch einen deutlichen Zusammenhang mit dem klinischen Verlauf und dem Überleben der Patientinnen fest. Diese Ergebnisse bilden die Grundlage für weiterführende Untersuchungen. Sie sollen klären, welche dieser Signal-Mechanismen sich als therapeutische Ziele eignen könnten.
Erfolg durch Interdisziplinarität
Die vorliegenden Forschungs-Ergebnisse sind insbesondere das Resultat einer intensiven interdisziplinären Zusammenarbeit zwischen dem IMT sowie der Klinik für Gynäkologie der Philipps-Universität. Die räumliche Nachbarschaft der jeweiligen Laboratorien im Marburger ZTI förderte einen schnellen Austausch. Zudem entwickelten die Forschungs-Teams ein Konzept zur engen Verzahnung von Klinik und Forschung. Konkret: Nach der Krebs-Diagnose leiteten die Ärzte am Universitätsklinikum Marburg die Behandlung ein – in der Regel eine operative Entfernung des Tumor-Gewebes. Dabei wurde auch der Aszites mit Einverständnis der Patientin in die ZTI-Labors übermittelt, dort aufgearbeitet und detaillierten Analysen unterzogen. Der Aszites ist besonders wertvoll als Untersuchungsmaterial, da es sehr viele Tumor- und Immunzellen enthält und so Forschungsarbeiten mit einem direkten klinischen Bezug ermöglicht: „Ein herausragendes Beispiel fachübergreifender Zusammenarbeit zwischen klinischen und grundlagenorientierten Forschern“, betont Sabine Müller-Brüsselbach.
Nicht zuletzt aufgrund der Erfolge aus dieser interdisziplinären Kooperation realisieren die ZTI-Forscher aktuell ein wichtiges infrastrukturelles Projekt: „Als Beitrag zu einer personalisierten Medizin arbeiten wir am Aufbau einer Datenbank speziell für Zellen und andere Bestandteile des Aszites von Patientinnen mit Ovarialkarzinom“, sagt Prof. Dr. Rolf Müller, ZTI-Leiter. Diese Bio- und Daten-Bank ist weltweit einmalig und von allen beteiligten Kooperationspartnern online abrufbar. Sie erfasst unter anderem in anonymisierter Form spezifische Daten wie klinische Verläufe und die Zusammensetzung des Aszites von Patientinnen. (idw, red)
Literatur:
Schumann T, Adhikary T, Wortmann A et al. (2015): Deregulation of PPARβ/δ target genes in tumor-associated macrophages by fatty acid ligands in the ovarian cancer microenvironment. Oncotarget 6: 13416-13433.
Reinartz S, Finkernagel F, Adhikary T et al. (2016): A transcriptome-based global map of signaling pathways in the ovarian cancer microenvironment associated with clinical outcome. Genome Biology 17: 108.
Artikel teilen