Krankenhausinfektionen gestern (2)
Krankenhausepidemien
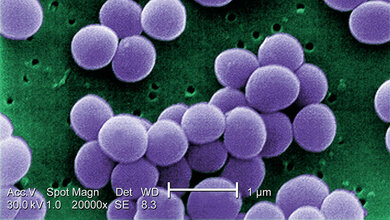
Die Staphylokokken des Phagentypus 80,81 haben alles, was ein Staphylokokkus braucht, um im Krankenhaus Unheil anzurichten. Im Allgemeinen sind sie resistent gegen Antibiotika, in Australien gegen Penicillin, in England, Europa und den Vereinigten Staaten meist gegen Penicillin, Tetrazyclin und Streptomycin. Sie scheinen eine besondere Fähigkeit dazu zu haben, die Haut zu besiedeln und Hautschäden hervorzurufen. Die Bedeutung liegt hier natürlich darin, dass sich Staphylokokken von infizierter Haut besonders leicht in der Umgebung ausbreiten können; deswegen würden also Hautinfektionen den Staphylokokken einen besonders großen Vorteil bei der Verbreitung verschaffen.
Zum ersten Mal wurde dieser S. aureus-Typ im Mai 1952 bei fünf Neugeborenen einer Entbindungsanstalt in Sydney, Australien, gefunden, die an ungewöhnlich schwerwiegenden S. aureus-Infektionen litten. Im November 1953 wurde dieser Epidemiestamm differenziert durch einen Phagen, der durch „Adaptation“ des Phagen 52A gewonnen worden war. Typ 80,81 ist auch offensichtlich in der Lage, bei kolonisierten Patienten Krankheiten hervorzurufen, und macht dies vermutlich im Verhältnis zur Anzahl befallener Personen viel häufiger als die meisten anderen Staphylokokkenstämme. Der Chirurg und Bakteriologe Williams aus London machte drei Faktoren dafür maßgeblich verantwortlich: Resistenz gegen Antibiotika, Fähigkeit zur Hautbesiedlung und Fähigkeit, bei kolonisierten Patienten, Krankheiten hervorzurufen. „Wir wissen nicht, warum 80,81, der im Laboratorium nicht viel aktiver als die anderen aussieht, in der Lage war, in Krankenhäusern so viel mehr Schäden anzurichten als die meisten anderen Staphylokokken.“
Der im Jahr 1954 zuerst erkannte Typ 80,81 nahm bis zum Jahr 1958 ständig an Prävalenz zu, aber kurz davor erschien ein neuer Typ „52,52A,80,81“ auf der Bildfläche und nahm ebenfalls während der nächsten Jahre ständig an Häufigkeit zu. Das Besondere des Komplexes „52,52A,80,81“ war, dass er über eine gesteigerte Fähigkeit verfügt, purulente Infektionen auszulösen. Dann traten um das Jahr 1958 in England Epidemien von Infektionen auf, die auf Typ 83 A beruhten. Auch diese nahmen während der nächsten Jahre an Häufigkeit zu [30]. Es wurden weitere neue Typen beschrieben. Wichtigstes Charakteristikum war ihre geringe Ausbreitungsfähigkeit bei oft hoher klinischer Virulenz. Solche Stämme werden mit Patienten laufend in Krankenhäuser eingeschleppt. Einige von ihnen können sich dort unter günstigen Umständen zu Epidemiestämmen entwickeln [40]. Mithilfe der Lysotypie gelang es oft, nähere Angaben hinsichtlich der Epidemiologie zu machen. Gelegentlich konnte dadurch sogar eine bestimmte infektionsunterhaltende Quelle entdeckt und nachfolgend durch gezielte Hygienemaßnahmen ausgeschaltet werden.
Krusche hat über Lysotypieergebnisse von Staphylococcus aureus bei Isolaten aus dem stationären und ambulanten Klinikbereich aus den Jahren 1949 bis 1981 weltweit und im Vergleich zu Bonner Ergebnissen folgende Erkenntnis zu den S. aureus-Stämmen des „52,52A,80,81“-Komplexes ausgewertet: Etwa ab 1955 wurde in vielen Ländern der Welt eine Zunahme der Hospitalinfektionen durch S. aureus-Stämme des „52,52A,80,81“-Komplexes beobachtet. Seit 1965 wurden Hospitalinfektionen durch diesen Typ weltweit nur noch sporadisch gefunden. Während seines pandemischen Auftretens verursachte er besonders häufig Infektionen auf Entbindungs- und Neugeborenen- und auf chirurgischen Stationen. Häufig rief er, bei meist schweren Krankheitsverläufen, Erkrankungen der Haut, postoperative Wundinfektionen, aber auch septische Krankheitsbilder und Pneumonien hervor [31].
Ähnliche Ergebnisse hatte Lyschik in der Akademischen Kinderklinik in Düsseldorf beobachtet [38]. S. aureus-Stämme dieses Typs scheinen häufiger Infektionen bei stationären Patienten hervorgerufen zu haben als bei Ambulanzpatienten und bei Personen der „Normalbevölkerung“. Viele Untersuchungsberichte wiesen auf die ungewöhnlich hohe Virulenz dieses Typs hin. Zunächst zeigten S. aureus-Stämme des „52,52A,80,81“-Komplexes meist nur eine Chemotherapeutikaresistenz gegen Penicillin G. Während ihrer pandemischen Ausbreitung wurden sie in vielen Ländern resistent gegen mehrere Chemotherapeutika. Gegenüber Methicillin und Gentamicin wurden kaum Resistenzen entwickelt [30]. Wahrscheinlich war aber eine ganze Reihe verschiedener Faktoren daran beteiligt. Antibiotikaabusus führte zur Resistenzsteigerung der Staphylokokken und damit zu Schwierigkeiten bei der Behandlung, mangelnde Aseptik förderte oftmals entscheidend die Ausbreitungsmöglichkeiten bestimmter Staphylokokkenstämme. Aber auch die durchschnittliche Resistenzlage der Patienten im Krankenhaus war offenbar niedriger als die der Patienten der 20er- und 30er-Jahre des letzten Jahrhunderts; höheres Alter der Patienten, größere und länger dauernde Eingriffe und so weiter.
Nach Anderson und Williams [32] gab es drei Typen von Epidemieausbrüchen:
1. Solche, die durch einen oder zwei Patienten oder durch ein oder zwei Mitglieder des Krankenhauspersonals ausgelöst werden, die einen bestimmten S. aureus-Stamm tragen. Nachdem diese, nach einer Behandlung, nicht mehr als Infektionsquelle infrage kommen und die neu infizierten Personen ebenfalls behandelt werden, sei die Epidemie beendet.
2. Epidemien, bei denen viele Träger innerhalb des Krankenhauspersonals gefunden werden können und wo eine Einschränkung des Infektionsgeschehens nur durch eine Verstärkung und verbesserte Organisation der Hygienemaßnahmen erreicht werden könne.
3. Infektionsgeschehen, bei denen S. aureus-Isolate unterschiedlicher Lysisbilder zum Beispiel in Operationswunden und beim Personal gefunden werden können.
β-Lactam-Antibiotika undKrankenhausinfektionen
In den 60er-Jahren konnte dann das Staphylokokkenproblem beziehungsweise der „Staphylokokken-Hospitalismus“ durch intensive hygienische, organisatorische Maßnahmen und neuere Penicilline, vor allem die β-Lactam-Antibiotika (Methicillin, Oxacillin), Nafcillin, Lincomycin1, und der Chephalosporine unter Kontrolle gebracht werden.
Um dem Staphylokokkenhospitalismus präventiv entgegenzuwirken, wurden zahlreiche Maßnahmen in die Praxis implementiert. Die wichtigsten Empfehlungen sind hier aufgeführt. Durch aseptische Maßnahmen:
• strenge Einhaltung des Grundsatzes der „Noninfektion“,
• Organisation der Pflege und Schulung des Personals unter dem Gesichtspunkt Vermeidung von Keimübertragungen (keine Fingerringe, keine Armbanduhren, keine Wollkleidung),
• weitgehende Separierung der Infizierten,
• Auflockerung der Belegdichte von Krankenzimmern und Sälen,
• Einhaltung eines ausreichenden Bettenabstandes,
• Zügelung des Besucherstromes und Aufforderung der Besucher zur Disziplin,
• Schaffung staubarmer Bedingungen (Fußboden, Einrichtung, Deckenheizung und so weiter),
• reichliche Lüftung,
• einwandfreie Beseitigung von Abfällen, gebrauchten Verbandsstoffen und so weiter,
• häufiger Wechsel der Schutzkleidung.
Durch antiseptische Maßnahmen:
• tägliche zuverlässige Desinfektion der Böden in Operations- und Verbandsräumen, von bestimmten Gegenständen wie Abfallbehältern, Wäschebehältern, Ablegeschalen und so weiter,
• ausreichende Desinfektion der Hände, auch beim Pflegepersonal,
• Desinfektion der Raumluft bei Bedarf,
• prä- und postoperativ soll der Nasen-Rachen-Raum aller Patienten der Bauch- und Thoraxchirurgie, die zur Operation anstehen, bakteriologisch auf pathogene Keime untersucht und überwacht werden. Finden sich pyogene Staphylokokken, so liegt eine latente Gefährdung des Patienten vor. Stellt man die ersten klinischen Zeichen dieser Infektion fest, so können aufgrund der Kenntnis der Resistenzlage des Bakterienstammes frühzeitig und damit erfolgreich die nötigen therapeutischen Maßnahmen ergriffen werden. Gerade bei den enterotoxischen Eigenschaften der Stämme ist diese Möglichkeit zum frühzeitigen gezielten Eingreifen oft von lebensrettender Bedeutung. Seit dieser Einführung in der chirurgischen Universitätsklinik der Technischen Universität zu München kam es bei keinem Kranken durch eine Staphylokokken-Enterocolitis zum Tod.
• Das Personal wird regelmäßig zweimal im Monat durch Nasen-Rachen-Abstriche auf Keimträger untersucht.
• Dauernde Keimausscheider versuchte man zu sanieren; bei Erfolglosigkeit ist die Keimstreuung auf andere Weise (Mundschutz, Separierung) auszuschalten.
• Strenge und planvolle Anwendung der Antibiotika [15].
1960 gelang es, den Grundbaustein aller Penicilline, die 6-Aminopenicillansäure (6-APS), zu isolieren. Dadurch wurden chemische Veränderungen in der Seitenkette des Penicillinmoleküls möglich, die zu neuen, sogenannten semisynthetischen Penicillinderivaten führten. Auf diese Weise wurde die enzymbedingte Penicillinresistenz der Staphylokokken überwunden. 1962 wurden aber wieder in verschiedenen Ländern Staphylokokken aus Untersuchungsmaterial isoliert, die nun gegen die semisynthetischen, penicillinasefesten Penicilline (ß-Lactamase) ein Resistenzverhalten (Methicillin und Oxacillin[→mecA-Gen]) zeigten.
Staphylococcus aureus hat in den letzten Jahrzehnten konstant die Fähigkeit gezeigt, Antibiotikaresistenz zu entwickeln. Stämme mit Mehrfachresistenz haben zunehmend weltweit Patienten besiedelt und infiziert. Auf die anfängliche Wirksamkeit neu eingeführter Antibiotika folgte stets die Entwicklung von Resistenz. Die Resistenz gegenüber Antibiotika wird zurückgeführt auf den Selektionsdruck, transduzierende Phagen und/oder Plasmide; DNA-Transfers durch Bakteriophagen. Chromosomale Gene tragen ebenfalls zur Resistenz gegenüber vielen Antibiotika bei; ebenfalls die extrachromosomale Resistenz (übertragbare, infektiöse Resistenz). Die Resistenz steht dabei im biologischen Wechselspiel zwischen Antibiotikum und Erreger [33, 44, 47].

Gramnegative Erreger als neue Hospitalerreger
Schwere und schwerste Infektionen mit gramnegativen Stäbchenbakterien traten nun auf, die zum Teil früher nicht als pathogen, sondern als normale Besiedler (fakultativ pathogene Erreger2) des menschlichen Darmes beziehungsweise als in der Umwelt vorkommend bekannt waren (E. coli, Enterokokken, Proteus, Pseudomonas aeruginosa, Klebsiellen, Enterobacter, Serratia, Bacteroides), die ebenfalls alle Charakteristika des infektiösen Hospitalismus aufwiesen, die bereits schon in den USA beschrieben wurden.
Tabelle 2 gibt dazu einen imposanten Überblick [43, 44]. Spitzy beschreibt den Hospitalismus durch gramnegative Erreger als Selektion der ubiquitären Patientenflora nach ihren resistenten Stämmen und Mutanten. Infolge der hohen Empfänglichkeit von schwerkranken Patienten (Polytraumen, Immunsuppression, komplizierte Operationen, Tracheotomie, Katheter sind ätiologische Komplikationsmöglichkeiten) werden die sonst harmlosen Keime der körpereigenen Mikroflora zu pathogenen Erregern, die als selektierte Opportunisten während des Krankenhausaufenthaltes zunehmen und sozusagen auf ihre „Chance“ warten, als Sepsiserreger auftreten zu können [42].
Herausragendes Ergebnis einer Untersuchung zur Veränderung der Körperflora bei Krankenhauspatienten zeigte in den 70er-Jahren des letzten Jahrhunderts bei chirurgischen Patienten die sehr hohe Nachweishäufigkeit gramnegativer Stäbchen. Bereits vor der Operation wurden bei einem Viertel aller Untersuchungen gramnegative Stäbchen, das heißt Coli, Klebsiellen, Proteus oder Pseudom. aeruginosa, gefunden, der letzte Keim allerdings nur bei 0,9 Prozent. Diese Nachweisfrequenz stieg bis zum zwölften Tag nach der Operation bis auf über 50 Prozent an. Bedeutend dabei ist die Tatsache, dass am zweiten und siebten Tag nach der Operation mehr als acht Prozent der Proben Pseudomonas aeruginosa enthielten. Fasst man die Ergebnisse zusammen, so muss festgestellt werden, dass die äußere Körperflora der Patienten, wobei sowohl Hautoberfläche wie auch Nasen-Rachen-Abstriche gemeint sind, in der Klinik offenbar charakteristischen Veränderungen unterliegt. Dabei spielt anscheinend das spezielle Milieu beziehungsweise eine mögliche Antibiotikatherapie eine sehr wesentliche Rolle. Die Bedeutung derartiger Veränderungen für das Zustandekommen von Krankenhausinfektionen sollte nicht unterschätzt werden [45]. Bei Patienten einer internistischen Intensivpflegestation mit und ohne Antibiotikatherapie wurden Stuhlproben auf aerobe Darmbakterien qualitativ und quantitativ mikrobiologisch untersucht. Die Stuhlflora von Patienten, die keine Antibiotikatherapie erhielten, entsprach im Wesentlichen einer Normalflora. Bei den mit Antibiotika behandelten Patienten traten Verschiebungen der Intestinalflora auf, die im Zusammenhang mit den verwendeten Antibiotika standen. Bei einer Cephalosporin-Monotherapie (Cefotaxim, Cefazolin) war E. coli weiterhin nachweisbar. Unter einer antibiotischen Zweifach- und Dreifach-Kombinationstherapie ging die Nachweishäufigkeit von E. coli deutlich zurück, während Pseudomonas aeruginosa wesentlich häufiger mit zunehmender Resistenz nachgewiesen wurde [46].
Die nosokomiale Sepsis ist heute die schwerste Form einer Infektion mit fakultativ pathogenen Keimen geworden, deren Erregerreservoir die normale Bakterienflora des Patienten beziehungsweise seiner nächsten Umgebung darstellt [44].
Fazit
Trotz aller Anstrengungen und Fortschritte in der Krankenhaushygiene ist der bakterielle Hospitalismus nach wie vor ein Problem ersten Ranges geblieben. Mit den Chemotherapeutika beziehungsweise Antibiotika wurden dem Arzt hochpotente Mittel in die Hand gegeben, die bei vielen schweren Infektionen lebensrettend sind. Als Nebenerscheinung werden jedoch durch eine Chemotherapie zwangsläufig aufgrund verschiedener Mechanismen resistente Mikroorganismen, besonders bei ungezielter Anwendung, herangezüchtet, die dann im Rahmen des bakteriellen Hospitalismus Bedeutung erlangen können.
Die Anwendung von Sulfonamiden und Antibiotika brachte trotz des zunehmenden Hospitalismus in den 50er-Jahren des letzten Jahrhunderts – zum Beispiel in der Neonatologie und Pädiatrie – einen deutlichen therapeutischen Effekt, der aus der Länge der Krankheitsdauer, der Sterblichkeit aller Säuglinge und Frühgeborenen zu beobachten war. Die durchschnittliche Krankheitsdauer betrug in der Vorsulfonamidzeit 23,5 und wurde durch die antibiotische Therapie auf 17,6 Tage verkürzt. Die Sterblichkeit, zum Beispiel der Staphylokokkenerkrankungen, konnte von 25 Prozent in der Vorsulfonamidzeit auf 6 Prozent in der antibiotischen Ära signifikant reduziert werden [37]. Erst die heutige „Hightech-Medizin“ mit ihren modernen Behandlungsmethoden ermöglichte –, dank unter anderem auch der Chemotherapeutika – Schwerkranke über längere Zeit am Leben zu erhalten und zu heilen. Die Intensivmedizin setzt direkt bei den versagenden Organen mit ihren supportiven Maßnahmen an, um deren Funktion zu bessern. Moderne Operationstechniken erlauben beispielsweise komplizierte Herzoperationen oder Organtransplantationen – besonders bei multimorbiden und geriatrischen Patienten –, Zytostatika werden in der Behandlung maligner Erkrankungen eingesetzt. Gerade die Behandlung dieser Kranken mit schlechter Immunität und auch deren Therapie birgt die Gefahr von iatrogenen und nosokomialen Infektionen in sich, die wiederum dann von den Antibiotika profitieren.
Einen wichtigen Faktor bei der Entstehung von im Hospital erworbenen Infektionen stellt auch der Patient und seine Infektionsbereitschaft dar. Ein kritisch Kranker kann selbst an seinen eigenen Darmbakterien erkranken, mit denen er sonst symbiotisch lebt, und sein Umfeld infizieren; Autoinfektion, die auf einer nicht mit der Hospitalisierung zusammenhängenden Disposition beruht. Durch episomale Resistenzübertragung3, zum Beispiel im menschlichen Darm, können resistente Stämme von gramnegativen Stäbchen auch ohne Kontakt mit einem Antibiotikum auftreten und sich in der Klinik ausbreiten [39, 42, 47]. Diese Tatsache allein erklärt, warum in bestimmten Bereichen des Krankenhauses stets auch aktuell mit Infektionsausbrüchen gerechnet werden muss. Die Prophylaxe von Hospitalinfektionen ist ein schwieriges Problem, da meist die Patienten selbst das Erregerreservoir darstellen. Wie in den 50er-Jahren des letzten Jahrhunderts und wie auch gegenwärtig zu beobachten ist, stellen nosokomiale Ausbrüche durch unterschiedlichste Erreger weiterhin eine immense Gefahr dar. Kliniken werden durch Ausbrüche stark belastet. Ausbrüche reduzieren die Produktivität einer Klinik, sie gefährden den Behandlungserfolg der Patienten, sie stellen dazu ein Risiko für die Mitarbeiter dar.
Antibiotika beeinflussen Krankenhausinfektionen wenig oder gar nicht. Infektionen entstehen mit oder ohne Antibiotika, sie beeinflussen die Art der Infektionserreger und die von ihnen ausgehenden Folgeschäden. Die Bekämpfung von Infektionen mit multiresistenten Erregern (MRE), die schwer behandelbar sind und bei denen gegenüber nichtresistenten Erregern zum Teil eine erheblich höhere Sterblichkeit besteht, ist eine gesamtgesellschaftliche Aufgabe und nur durch Zusammenarbeit aller Mitarbeiter an der Gesundheitsversorgung zu erreichen. Der Wiener Infektiologe, Prof. Dr. Spitzy, forderte bereits im Jahr 1977: „Gerade wegen der Keimselektion und der drohenden infektiösen Resistenz ist allergrößter Wert auf die Krankenhaushygiene zu legen. Ebenso wenig können aber rigorose Beschränkung oder Wechsel der Antibiotika, Schaukeltherapie, restlose Ablehnung jeder Chemoprophylaxe – und damit sicher auch jeder frühzeitigen Chemotherapie – erfolgreich sein. Kluges Abwägen der Therapie im Einzelfall, ständige Kontrollen der Keimsituation und strengste Krankenhaushygiene sind allein imstande, den ,modernen‘ Hospitalismus ,unmodern‘ werden zu lassen“ [42].
Der ehemalige Leiter des Nationalen Referenzzentrums für Staphylokokken am Robert Koch-Institut, Prof. Dr. Witte, resümierte: „Auftreten und Verbreitung multiresistenter Erreger von Krankenhausinfektionen werden durch Bereiche eines hohen chemotherapeutischen Selektionsdruckes und Mängel in der Krankenhaushygiene begünstigt. Aus dieser Sicht sind Regime des Chemotherapeutikaeinsatzes und der Krankenhaushygiene zwei Seiten der gleichen Medaille“ [37].
Anmerkungen
1 Lincomycin ist ein Antibiotikum, das in Deutschland lediglich zum Einsatz in der Veterinärmedizin zugelassen ist.
2 Fakultativ pathogene Bakterienspezies, die bei Menschen mit guter Abwehrlage ihre krankmachenden Fähigkeiten nicht entwickeln können und als Infektionserreger eine untergeordnete Rolle – sogenannte Opportunisten – spielen. Erst unter dem Einfluss der modernen und zum Teil aggressiven Verfahren der Medizin (unter anderem Immunsuppression, medikotechnische Interventionen et cetera) können diese ihre Pathogenität entfalten.
3 Die übertragbare Resistenz tritt meist unbemerkt ein und kommt bei gramnegativen Stäbchenbakterien vor. Das extrachromosomal gelagerte Genmaterial wird durch Konjugation von einer Bakterienart auf die andere unter Einschaltung eines »Resistenz-Transfer-Faktors« übertragen. Eine extrachromosomale Resistenzübertragung wurde auch bei Staphylokokken beobachtet. Die Übertragung einer Mehrfachresistenz kann im menschlichen Darm, auf Schleimhäuten oder auf der Haut stattfinden.
Literatur
1. Klinisches Wörterbuch. Walter de Gruyter & Co. Auflage 1959. 123–53.
2. Schär M: Bekämpfung der Krankheitsübertragung in Spitälern durch hygienische Maßnahmen. VESKA 1964; 12: 1195–205.
3. Gerisch G, Viertel G: Der bakterielle Hospitalismus aus klinischer Sicht. Zentralblatt für Gynäkologie 1965; 87: 1–16.
4. Kikuth W, Grün L: Zur Hygiene und Bakteriologie des Staphylokokken-Hospitalismus. Deutsche Medizinische Wochenschrift 1957; 82: 549–53.
5. Grün L: Staphylokokken in Klinik und Praxis. Wissenschaftliche Verlagsgesellschaft Stuttgart 1964.
6. Grün L: Die Entstehung und Vermeidung des modernen Hospitalismus – Allgemeines über Hospitalismus und seine Bekämpfung. Therapiewoche 1962; 4: 131–5.
7. Kothe W, Reichmann J: Antibiotikaresistenz und Hospitalismus. Das deutsches Gesundheitswesen. 1970; 2527: 1261–4.
8. Good H: Neue Erkenntnisse auf dem Gebiet des Hospitalismus als Appell zur totalen Asepsis und Antisepsis im Krankenhaus. In: Krankenhausprobleme der Gegenwart. 1968. Band 8. Hans Huber Verlag Bern.
9. Windorfer A: Der Hospitalismus in Kinderklinik und Praxis. Therapiewoche 1962; 4: 139–42.
10. Williams RO, Jevons MP: Nasal Staphylococci and Sepsis in Hospital Patients. British Medical Journal 1959; 10: 659–62.
11. Willimas REO, Nobele WC, Jevons MP, et al.: Isolation for the Control Staphyloccal Infection in Surgical Wards. British Medical Journal 1962: 276; 275–82.
12. Jennings PA: Krankenhausinfektionen. Bundesgesundheitsblatt. 1964; 7: 241–5.
13. Reber H: Infektionshospitalismus. Der Chirurg 1967; 38: 154–8.
14. Matz K: Epidemiologische Gesichtspunkte beim Staphylokokkenhospitalismus. Die Medizinische Welt 1967; 7: 353–6.
15. Maurer G: Maßnahmen zur Einschränkung des Staphylokokken-Hospitalismus. Langenbecks Archiv für klinische Chirurgie 1957; 287: 80–6.
16. Grumbach A, Kikuth W: Die Infektionskrankheiten des Menschen und ihre Erreger. 2nd edition. Stuttgart: Georg Thieme Verlag 1969. 123–53.
17. von Ondarza R: Hospitalismus. Vorträge aus der praktischen Chirurgie. Stuttgart: Ferdinand Enke Verlag 1964, Heft 65.
18. Wentworth FH, Miller AL, Wentworth BB: Hospital-acquired staphylococcal disease and the community. Public Health Rep 1958; 73: 1092–5.
19. Höring FO: Symbiose und Antibiose. Deutsch Med Jour 1953; 4: 9–12.
20. Kikuth W: Hospitalismus; bakteriologisches Referat. Langenbecks Archiv für klinische Chirurgie. 1957; 287: 65–74.
21. Johnstone FR: An assessment of prophylactic antibiotics in general surgery. Surg Gynecol Obstet 1963; 116: 1–10.
22. Jacherts D: Bakterienphysiologische Grundlagen des Hospitalismus. Dtsch Med Wochenschr 1961; 86 (44) 2116–9.
23. Maclean RC, Hall AR, Perron GG, Buckling A: The evolution of antibiotic resistance: insight into the roles of molecular mechanisms of resistance and treatment context. Discovery Medicine 2010: No 10, 51; 112–8.
24. Alexander M: Erregerwechsel in verschiedenen Krankenhausbereichen im Verlaufe der letzten 20 Jahre unter Einfluß der Antibiotikabehandlung. Immunität und Infektion. 1977; 5: 2: 62–5.
25. Irmer W, Thum HJ, Escher R: Der Hospitalismus in der chirurgischen Klinik. Therapiewoche 1962; 4: 135–9.
26. Spitzy KH: Was ist Hospitalismus? Allmanach für die ärztliche Fortbildung. 1963: 15–21.
27. Meyer W, Rische H, Witte W: Epidemiologische Überwachung von Staphylococcus aureus. In: Beiträge zur Hygiene und Epidemiologie. Habs H, Rische H (eds,). Bd. 24. Leipzig: Johann Ambrosius Barth 1978.
28. Naumann P: Moderner Hospitalismus – Ein Beitrag zu den Kausalfaktoren der Probleminfektion aus bakteriologischer Sicht. Zbl Chir 1976; 101: 449–57.
29. Naumann P: Pharmakokinetik der Chemotherapie auf dem Gebiet der Problemkeime. In: Holtmeier J, Weisbecker L (eds.): Chemotherapie der Problemkeime. 11. Symposium der deutschen Gesellschaft für Fortschritte auf dem Gebiet der Inneren Medizin. Freiburg 1973. Stuttgart, New York: Georg Thieme Verlag 1974.
30. Williams REO: Die Epidemiologie der Staphylokokken-Infektion im Krankenhaus. Das Krankenhaus 1964; 4: 146–9.
31. Krusche M: Lysotypieergebnisse von Staphylococcus aureus bei Isolaten aus dem stationären und ambulanten Klinikbereich aus den Jahren 1949 bis 1981 weltweit und im Vergleich zu Bonner Ergebnissen. Inaugural-Dissertation. Rheinische Friedrich-Wilhelms-Universität zu Bonn 1986.
32. Anderson ES, Williams REO: Phage typing of enteric pathogens and staphylococci and its use in epidemiology. J Clin Path 1956; 9: 115–27.
33. Schütze E: Aktuelle Probleme der Antibiotikaresistenz bakterieller Erreger. Internist 1967: 8: 6; 2008–14.
34. Irmer W: Verhütung der Wundinfektion. In: Kremer K, et al. (eds.): Intra- und postoperative Zwischenfälle. Ihre Verhütung und Behandlung In 4 Bänden. Bd. 1, 2nd edition. Georg Thieme Verlag 1981; 211–25.
35. Schaub F: Schäden und Krankheiten mit Antibiotika. Internist 1962: 3: 431–7.
36. Bloch H: Brauchen wir heute noch neue Antibiotika und Chemotherapeutica? Schweiz Med Wschr 1968; 98: 611.
37. Witte W, Klare I, Fock R: Chemotherapeutikaresistenz bei bakteriellen Infektionserregern und infektiöser Hospitalismus. Infektionsepidemiologische Forschung. InfFo II/96. Robert Koch-Institut Berlin. Juni 1996.
38. Lyschik B: Studien zum Staphylokokken-Hospitalismus anhand des Krankengutes der letzten 30 Jahre der Akademischen Kinderklinik Düsseldorf. Dissertation der Medizinischen Akademie in Düsseldorf 1962.
39. Caselitz FH, Freitag V: Der Hospitalismus aus bakteriologischer Sicht. Klin Wschr 1977; 55: 1185–90.
40. Fischer R, Witte W, Penndorf I: Zur Epidemiologie des indirekten Staphylokokkenhospitalismus. Z Klin Med 1986; 41: 779–81.
41. Meyer W: Staphylokokken und Staphylokokken-Erkrankungen. 1984. Bd. 20. Hrsg. Köhler, W. Mayr, MT Pulawy. VEB Fischer Verlag Jena, DDR. (Anmerkung des Verfassers: Das wohl umfangsreichste deutschsprachige Werk über Staphylokokken bis dato)!
42. Spitzy KH: Entwicklung und klinische Bedeutung des bakteriellen Hospitalismus. Hexagon Roche. 1977; 5; (1) 11–7.
43. Finland M: Changing prevalence of pathogenic bacteria in relation to time and the introduction and use of new antimicrobial agents. In: Finland M., Alarget W und Bartmann K (eds): Bacterial infections. Berlin, Heidelberg, New York: Springer Verlag 1971.
44. Stille W: Septikämie, Problematik, Klinik und Therapie. Beecham Pharma Mainz-Weisenau, 2nd edition, 1972.
45. Von Hehn A, Gundermann KO: Veränderungen der Körperflora bei Krankenhauspatienten. Zbl Bakt Hyg, I Abt. Orig A. 1974; 228: 7–10.
46. Beck EG, Pavel Schmidt P: Hygiene in Krankenhaus und Praxis. Infektiöser Hospitalismus. Berlin, Heidelberg: Springer Verlag 1986.
47. Simon C, Stille W: Antibiotika-Therapie in Klinik und Praxis. 6th edition, Stuttgart, New York: Schattauer Verlag 1985.
48. Vogel F, Oermann R, Knothe H. Veränderungen der Darmflora unter Antibiotikatherapie bei schwerkranken Patienten. Umweltmedizin [1985] 4: 63–66.
Entnommen aus MTA Dialog 10/2018
Artikel teilen