Über die neuen Erkenntnisse berichten Wissenschaftlerinnen und Wissenschaftler am Helmholtz Zentrum München, Partner im Deutschen Zentrum für Lungenforschung (DZL), gemeinsam mit Kollegen vom Klinikum der Ludwig-Maximilians-Universität München und dem Max-Planck-Institut für Biochemie in Martinsried bei München.
Mechanismen bisher nicht ausreichend bekannt
Der Begriff interstitielle Lungenerkrankung (ILD) fasst eine Vielzahl verschiedener Krankheitsbilder zusammen, die mit einer Vernarbung (Fibrose) des Lungengewebes verbunden sind. Die idiopathische Lungenfibrose (IPF) ist eine davon. Dabei kommt es zu einer vermehrten Bildung von Bindegewebe in der Lunge, was deren Dehnbarkeit verringert, die Sauerstoffaufnahme beeinträchtigt und insgesamt zu einer Verschlechterung der Lungenfunktion führt.
„Die hinter den einzelnen Krankheitsbildern liegenden Mechanismen sind nicht ausreichend bekannt und daher Gegenstand unserer Forschung“, erklärt Dr. Herbert Schiller. Er ist seit vorletztem Jahr DZL-Nachwuchsgruppenleiter am Institut für Lungenbiologie des Helmholtz Zentrums München und war zuvor am Max-Planck-Institut für Biochemie tätig. Gemeinsam mit der dort ansässigen Gruppe von Prof. Dr. Matthias Mann haben er und sein Team nun Gewebeproben von ILD-Patienten massenspektrometrisch untersucht.
Autoimmunerkrankung gegen noch unbekannte Proteine?
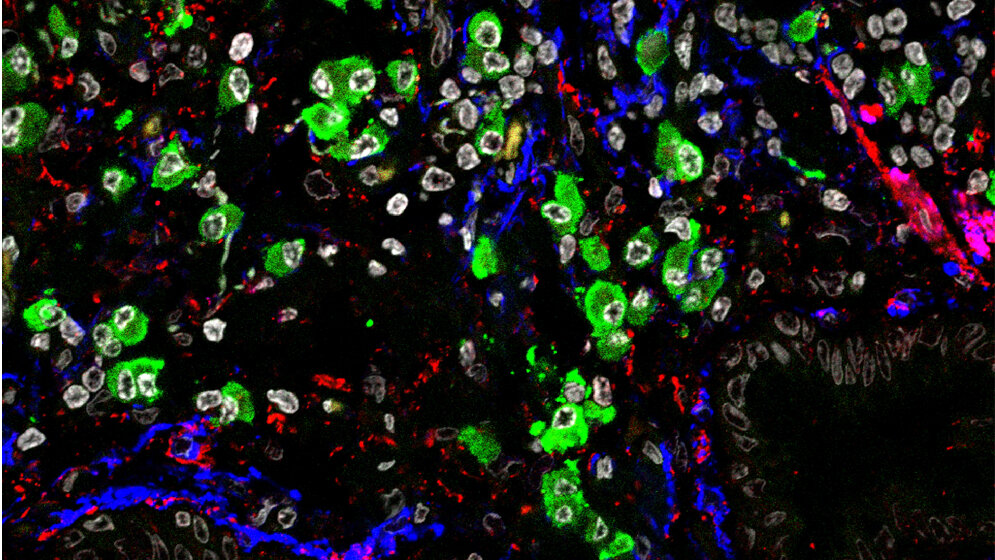
Insgesamt analysierten die Wissenschaftler Lungengewebe von 45 Patientinnen und Patienten mit verschiedenen ILD-Formen und verglichen sie mit den Proben von zehn gesunden Kontrollpersonen. Darüber hinaus untersuchten sie bei sechs Patienten mit fibrotischen Hauterkrankungen das Gewebe aus erkrankten und gesunden Hautbereichen.
„Interessanterweise konnten wir sowohl in der Lunge als auch in der Haut der Fibrose-Patienten vermehrt Proteine identifizieren, die maßgeblich in Antikörper produzierenden B-Zellen, sogenannten Plasmazellen, vorkommen“, erklärt Erstautor Schiller. Beobachtungen unter dem Mikroskop konnten diese Ergebnisse bestätigen. Das ließe vermuten, dass bei manchen Patienten womöglich eine Autoimmunerkrankung gegen noch unbekannte Proteine in der Lunge ursächlich an der Krankheit beteiligt sei, so die Autoren.
Weitere Studien geplant
„In unserer Arbeit haben wir zahlreiche Antikörper bildende Plasmazellen im vernarbten Lungengewebe gefunden und die Menge dieser Zellen war mit der Abnahme der Lungenfunktion der Patienten korreliert“, erklärt Schiller. Ein kausaler Zusammenhang lässt sich zum gegenwärtigen Zeitpunkt nicht direkt beweisen, daher sind bereits weitere Studien geplant.
„Der Schlüssel zur besseren diagnostischen Einordnung in der Zukunft und möglichen immuntherapeutischen Ansätzen könnte die massenspektroskopische Identifikation von Autoantikörpern und deren Antigenen aus dem Blut von ILD-Patienten sein“, blickt Schiller voraus. Seine Nachwuchsgruppe sei derzeit dabei, neue Methoden zur Charakterisierung der Autoantikörper zu entwickeln und an größeren Patientenkohorten zu untersuchen. (idw, red)
Hintergrundinformationen:
„Insbesondere bei der idiopathischen pulmonalen Fibrose (IPF) ist die Krankheitsursache bisher völlig ungeklärt“, erläutert Schiller. „Die Prognose der IPF mit einem durchschnittlichen Überleben von zwei bis fünf Jahren nach Diagnosestellung ist als schlecht einzustufen und vergleichbar mit dem von vielen Krebs Erkrankungen der Lunge.“ Seit kurzem stehen zur Therapie der IPF die beiden antifibrotischen Medikamente Pirfenidon und Nintedanib zur Verfügung. Da die antifibrotischen Medikamente allerdings letztlich den Krankheitsverlauf nur verlangsamen aber nicht aufhalten können, bleibt zum jetzigen Zeitpunkt die Lungentransplantation die einzige definitive Therapie der IPF.
Herbert Schiller leitet seit Oktober 2015 die DZL Nachwuchsgruppe „Systemmedizin chronischer Lungenkrankheiten“ am Institut für Lungenbiologie des Helmholtz Zentrums München. Letztautor der Studie ist Prof. Dr. Oliver Eickelberg. Er war bis Ende vergangenen Jahres Direktor des Instituts für Lungenbiologie am Helmholtz Zentrum München. Aktuell ist er Leiter der Division of Pulmonary and Critical Care Medicine an der School of Medicine der Universität von Colorado in Denver.
Die Doktoranden Christoph Mayr und Maximilian Strunz aus der Nachwuchsgruppe von Herbert Schiller sind Mitglieder der CPC Research School „Lung Biology and Disease“ und Teilnehmer an der Helmholtz Graduate School Environmental Health, kurz HELENA.
Schiller, HB. et al. (2017): Deep proteome profiling reveals common prevalence of MZB1-positive plasma B cells in human lung and skin fibrosis. American Journal of Respiratory and Critical Care Medicine, DOI: 10.1164/rccm.201611-2263OC.
Artikel teilen