Bisher unbekannter Mechanismus der Blutkrebsentstehung
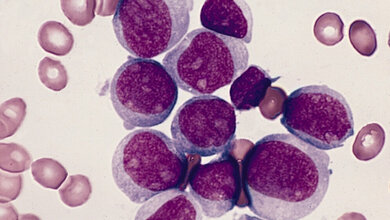
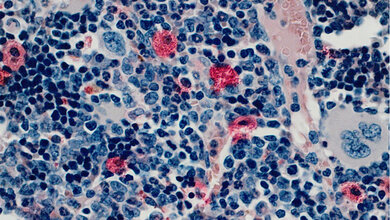
Die Akute Myeloische Leukämie äußert sich unter anderem durch Schwächezustände, Blutarmut oder Infektanfälligkeit. Auslöser ist die Entartung einer Gruppe blutbildender („myeloischer“) Zellen: Sie teilen sich ungebremst und produzieren fast ausschließlich so genannte Blastenzellen. Diese Blastenzellen stören nicht nur die normale Blutbildung im Knochenmark, sondern können auch verschiedene Organe direkt schädigen. Bei einer bestimmten Art der AML kommt dem „Krebsprotein“ AML1-ETO eine Schlüsselrolle zu, da es die Genexpression der Krebszellen verändert. Ulmer Forscher konnten jetzt zeigen, dass dieses Protein eine weitere, bisher unbekannte Funktion erfüllt: Es beeinflusst auch die Expression von Genen, die normalerweise durch das Notch-Protein reguliert werden. Das Notch-Protein spielt sowohl bei der Zellteilung als auch bei der Zelldifferenzierung eine wichtige Rolle.
Essentieller Schritt bei der Leukämie-Entstehung?
In Zellkultur-Experimenten und im Mausmodell haben Geiger und Oswald den neuen Wirkmechanismus der aggressiven Variante des AML1-ETO Krebsproteins (AE9a) nachgewiesen: Genau wie das Notch-Protein selbst aktiviert es also die Expression von Notch-Zielgenen. Eine veränderte Form des Krebsproteins, welches keine Notch-Zielgene mehr beeinflusst, löst jedoch keine Blutkrebserkrankung aus. „Daher scheint dieser neu entdeckte Mechanismus ein essentieller Schritt bei der Leukämie-Entstehung zu sein“, erklärt Professor Franz Oswald vom Zentrum für Innere Medizin der Universitätsklinik Ulm.
Auch bei AML-Patienten zu finden
Gemeinsam mit den Ulmer Ärzten Professor Lars Bullinger und Professorin Konstanze Döhner von der Universitätsklinik für Innere Medizin III konnte die Gruppe weiterhin zeigen, dass diese aggressive Variante des AML1-ETO Krebsproteins auch bei AML-Patienten zu finden ist – und durch ein charakteristisches Genexpressions-Profil identifiziert werden kann. Künftig könnten diese Forschungsergebnisse die Blutkrebstherapie verbessern: „Bei der speziellen AML-Variante lässt sich der nun entdeckte Wirkmechanismus womöglich als therapeutischer Angriffspunkt nutzen“, präzisiert Professor Hartmut Geiger, Leiter des Instituts für Molekulare Medizin. (idw, red)
Prof. Franz Oswald forscht am Ulmer
Zentrum für Innere Medizin Foto: privat
Hintergrundinformation:
Die Studie wurde im Rahmen des Ulmer „Leukämie-Sonderforschungsbereichs“ (SFB 1074) von der Deutschen Forschungsgemeinschaft (DFG) sowie unter anderem vom Bundesministerium für Bildung und Forschung (BMBF) unterstützt.
V Thiel, BD Giaimo, P Schwarz, et al.: Heterodimerization of AML1/ETO with CBFβ is required for leukemogenesis but not for myeloproliferation. Leukemia. DOI:10.1038/leu.2017.105.
Artikel teilen