Bei Blutvergiftung, Hämolyse oder gehäuften Bluttransfusionen müssen viele rote Blutkörperchen auf einmal abgebaut werden. Wird das darin enthaltene Eisen frei, kann es schwere Organschäden verursachen. Wie der Körper in solchen Notsituationen das Blut abbaut, haben jetzt Wissenschaftler des Universitäts-Herzzentrums Freiburg, Bad Krozingen und des Universitätsklinikums Freiburg gemeinsam mit Forschern aus den USA und Österreich herausgefunden. Sie zeigten bei Mäusen, dass in solchen Fällen nicht die Milz, wie bislang gedacht, sondern die Leber der Hauptabbau-Ort für rote Blutkörperchen ist.
Bessere Behandlung möglich
Einen Großteil der Arbeit übernehmen Immunzellen, die extra in die Leber einwandern und sich dort zu hochspezialisierten Eisenverwertern entwickeln. Auch beim Menschen existiert ein vergleichbarer Mechanismus, wie die Forscher nachwiesen. Die Erkenntnisse ermöglichen einen neuen Ansatz, um Komplikationen nach Bluttransfusionen oder Blutvergiftung besser zu behandeln.
„Wir haben erstmals Kompensationsmechanismen beschrieben, die den Körper bei einem verstärkten Abbau von roten Blutkörperchen vor Eisenvergiftung schützen“, sagt Dr. Ingo Hilgendorf, einer der Erstautoren der Studie und Forschungsgruppenleiter in der Klinik für Kardiologie und Angiologie I am Universitäts-Herzzentrum Freiburg, Bad Krozingen (Ärztlicher Direktor: Univ.-Prof. Dr. Dr. h.c. Christoph Bode).
tMacs können mehr Eisen aufnehmen als jeder andere Zelltyp
Die Forscher wiesen nach, dass Monozyten-Immunzellen in die Leber einwandern und sich nur hier aufgrund der für die Leber einzigartigen Zusammensetzung an Wachstumsfaktoren zu sogenannten transitorischen Makrophagen (tMacs) entwickeln. Diese tMacs können mehr Eisen aufnehmen als jeder andere Zelltyp. Bei Bedarf stellen sie das Eisen auch wieder für den Aufbau roter Blutkörperchen zu Verfügung. Sie unterstützen damit die eisen-verwertenden Kupfferzellen, die bereits mit der Geburt in der Leber angelegt sind.
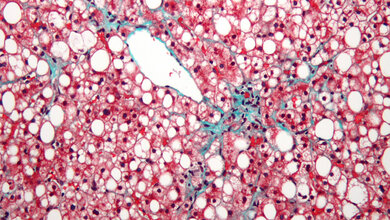
Blockierten die Forscher die Wanderung von Monozyten in die Leber, waren die Zellen in Milz und Leber mit dem Eisenrecycling überfordert. Die Folge: Eisen wurde freigesetzt und es entstanden Leber- und Nierenschäden (Abbildung). Derartige Komplikationen sind auch von Patienten mit gestörtem Blutabbau bekannt.
Bei Patienten ebenfalls die eingewanderten Zellen nachgewiesen
Die Forscher untersuchten auch Patienten, die aufgrund einer koronaren Bypass-Operation an eine Herz-Lungen-Maschine angeschlossen waren. Der Einsatz der Maschine führt zu einem deutlich höheren Verschleiß roter Blutkörperchen und damit zu erhöhten Abbauraten. Bei diesen Patienten konnten sie ebenfalls die eingewanderten Immun-Zellen nachweisen. „Auf Grundlage unserer Arbeiten werden wir nun untersuchen müssen, ob die Immunzellen gezielt aktiviert werden können, um Komplikationen bei erhöhtem Erythrozytenzerfall zu vermeiden“, sagt Dr. Hilgendorf.
Paradebeispiel für interdisziplinäre Forschung
Durch Verwendung eines bereits etablierten Mausmodells zur genetischen Markierung dieser Immunzellen, das vom Co-Autor Prof. Dr. Marco Prinz, Ärztlicher Direktor des Instituts für Neuropathologie des Universitätsklinikums Freiburg, entwickelt worden war, waren die Forscher in der Lage, die eingewanderten und die ortstreuen eisenspeichernden Zellen der Leber zu unterscheiden. "Auf den ersten Blick sehen beide Zelltypen identisch aus. Mit einem genetischen Marker konnten wir jetzt die genetische Abstammung und Entwicklung der unterschiedlichen Zellen sehr präzise verfolgen", sagt Prof. Prinz.
Die aufwendigen Versuche entstanden über einen Zeitraum von über vier Jahren in Zusammenarbeit mit Kollegen aus Boston, USA, Innsbruck, Österreich, sowie mit Kooperationspartnern der Albert-Ludwigs-Universität Freiburg.
"Diese Arbeiten sind ein Paradebeispiel interdisziplinärer Forschung, die vom Reagenzglas über das Mausmodell letztlich unseren Patienten zugutekommt", sagt Prof. Bode. "Es ist die Aufgabe der Universitäten, besonders begabte Ärzte für die Grundlagenforschung zu begeistern, da nur die Doppelausbildung zu Durchbrüchen im Verständnis von Krankheiten befähigt. Dieser Aufgabe kommt die Universität Freiburg in exemplarischer Weise nach." (idw, red)
On-demand erythrocyte disposal and iron recycling requires monocyte-derived transient macrophages in the liver, DOI: 10.1038/nm.4146
Artikel teilen