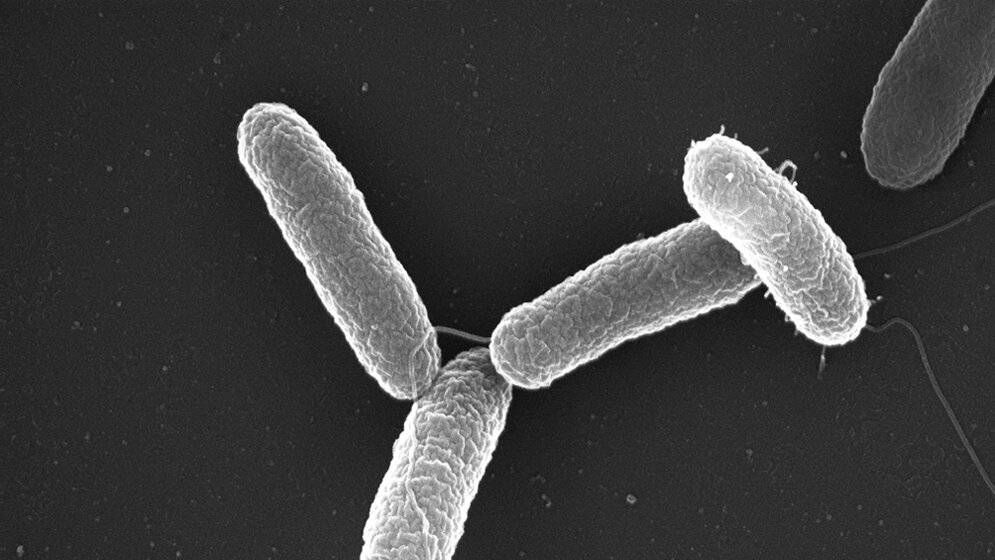
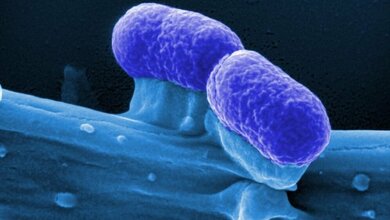
Forscherinnen und Forscher am Exzellenzcluster für Alternsforschung CECAD haben unter Leitung von Nirmal Robinson einen Mechanismus entdeckt, wie es dem Keim gelingt, das Immunsystem „auszutricksen“. Sie hoffen das Wissen im Kampf gegen Krebs einsetzen zu können. Unser Immunsystem hat unterschiedliche Möglichkeiten, mit Bedrohungen von außen, wie zum Beispiel Bakterien, umzugehen. Einer dieser Verteidigungsmechanismen ist die sogenannte Autophagie. „Man kann sich Autophagie wie den Staubsauger der Zelle vorstellen“, sagt Nirmal Robinson, Hauptautor der neuen Veröffentlichung zum Thema. „Sie hält die Zelle sauber durch Abbauen und Entfernen von Krankheitserregern oder beschädigten Teilen der Zelle.“ Dadurch wird die Anhäufung von zellulärem Abfall verhindert und die Funktion der Zellbestandteile bleibt erhalten. Ein Rückgang der Autophagie spielt auch eine wichtige Rolle im Alterungsprozess und bei der Langlebigkeit. Wenn mit Autophagie verknüpfte Gene aus Organismen wie dem Fadenwurm C. elegans entfernt werden, stirbt dieser deutlich früher.
Salmonella typhimurium für die Forschung
Für seine aktuelle Forschung nutzte Robinson das Bakterium Salmonella typhimurium. Mit 13.823 gemeldeten Fällen in Deutschland im Jahr 2015 gehören Salmonellen zu den häufigen Infektionskrankheiten bei Menschen. Bei gesunden Menschen verschwinden die Symptome ohne antibiotische Behandlung, für Risikogruppen wie ältere Menschen oder Personen mit geschwächtem Immunsystem besteht die Gefahr ernsthafter gesundheitlicher Folgen.
Von diesem Organismus ist bekannt, dass er der Autophagie entkommt. Ziel der Forscher war es zu entschlüsseln, wie der Keim den Prozess erkennen und austricksen kann. Sie haben herausgefunden, dass zwei Eiweiße, die Änderungen im Stoffwechsel messen, bei der Infektion reduziert werden. Normalerweise wird ein Energieverlust in der Zelle von dem Eiweiß AMPK bemerkt – das ist der Auslöser von Autophagie. Sirtuine sind eine weitere Art von Stoffwechselsensoren und ihre Funktion hängt von dem Stoffwechselprodukt NAD+ ab.
Proteine in den Lysosomen abgebaut
Zusammen tragen sie dazu bei, dass die Autophagie ausgelöst wird. Bei Infektionen tritt ein Energieverlust auf, der normalerweise Autophagie auslöst. Für Robinsons Forschung wurden Immunzellen mit dem Erreger infiziert. Wie anzunehmen sank das Energielevel. Dann war zu erwarten, dass AMPK aktiviert würde – was auch geschah, aber nur für eine sehr kurze Zeit. Obwohl das Energielevel niedrig bleibt, wird die Aktivierung nicht erhalten. Weitere Untersuchungen des Prozesses enthüllten den Mechanismus. Bald nach der Infektion werden die für Auslösung der Autophagie benötigten Proteine in den Lysosomen (Zelleinheiten die Abbauenzyme enthalten) abgebaut. „Das Pathogen nimmt also die Maschinerie auseinander, indem es sie für den Abbau markiert – und so dem Immunsystem entkommt“, so der Forscher.
Auch therapeutisch einsetzbar?
Nirmal Robinson hofft durch das verbesserte Verständnis des Prozesses der Autophagie Wege zu finden, wie man dies therapeutisch einsetzen kann. „Wir können lernen, diesen Pfad zu nutzen.“ In Krebszellen zum Beispiel ist die Autophagie hochreguliert, damit sie schnell wachsen und Stress überstehen können. Die Forscher würden gerne in den Prozess eingreifen und das Level der Autophagie erhöhen und senken, gerade so, wie sie es brauchen. Seine Arbeit vergleicht Robinson mit einer alltäglichen Situation. „Krankheitserreger sind wie Einbrecher. Indem wir ihnen folgen, können wir sehen, wo wir Schwächen haben.“ Durch ein Verständnis der Interaktion zwischen Wirt und Eindringling, können wir mehr über unseres eigenes Selbst verstehen und wie unsere Verteidigungsmechanismen gegen Bedrohungen von außen aufgebaut sind. (idw, red)
Ganesan R, Hos NJ, Gutierrez S, et al. (2017): Salmonella Typhimurium disrupts Sirt1/AMPK checkpoint control of mTOR to impair autophagy. PLoS Pathog 13(2): e1006227. DOI:10.1371/journal.ppat.1006227.
Artikel teilen