Ähnliche Mechanismen beim Infizieren
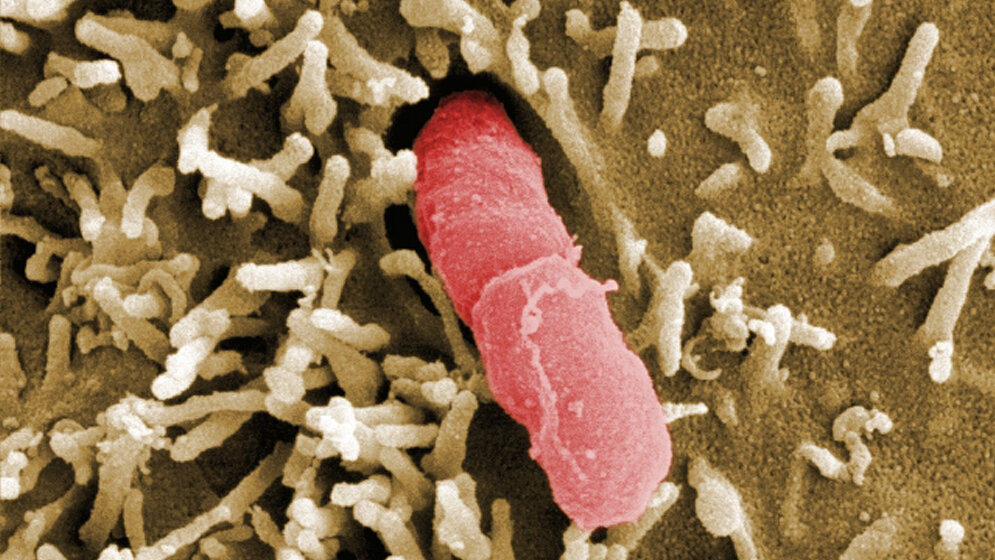
Um den Darm zu besiedeln, müssen Yersinia-Bakterien zunächst an die Oberfläche der Darmschleimhaut binden. Sie passieren diese, um in tieferliegende Gewebe einzudringen und zu den Organen zu gelangen. „Die Mechanismen, mit denen unterschiedliche Yersinia-Bakterien die Wirtszellen infizieren und ihre Ausbreitung im Wirt steuern, sind sehr ähnlich. Wir untersuchen deshalb im Labor eine weniger gefährliche Verwandte aus der Familie der Yersinien: den Modellorganismus Yersinia pseudotuberculosis. Der Erreger besitzt viele Gemeinsamkeiten mit dem Pesterreger Yersinia pestis“, sagt HZI-Wissenschaftlerin Prof. Petra Dersch, Leiterin der Abteilung „Molekulare Infektionsbiologie“. Es reicht aber nicht, das Gewebe des Wirtes zu besiedeln, die Bakterien müssen auch den Kampf gegen dessen Immunsystem gewinnen. „Bisher wurden solche Studien nur in vitro, also in Zellkultur unter Laborbedingungen, durchgeführt. Dabei lässt sich zwar die Wirtsumgebung (höhere Temperatur, mehr Nährstoffe) nachahmen, aber nicht der Einfluss des Immunsystems“, sagt Dersch.
Regulationsmechanismen angeschaut
Um besser zu verstehen, wie eine Yersinien-Infektion abläuft, müssen sich die Wissenschaftler die Regulationsmechanismen anschauen, die in Gang gesetzt werden, wenn ein Krankheitserreger einen lebenden Wirt befällt. Dazu versuchten Dersch und ihr Team nun, mit modernsten Sequenziermethoden und umfangreichen bioinformatischen Analysen an infizierten Mäusen aufzuklären, mit welchen Strategien und Mechanismen der Krankheitserreger Yersinia seinen Wirt infiziert und wie das Immunsystem darauf reagiert. Dersch: „Unsere Analyse tausender Gene auf Transkriptomebene zeichnet eine genaue Landkarte eines harten Kampfes während der Infektion durch das Pathogen und der darauffolgenden Immunabwehr der Maus.“
Clots sind wichtig für das Immunsystem
Für die Studie wurde mit Yersinien infiziertes lymphatisches Gewebe von Mäusen untersucht, welches eng mit dem Darm assoziiert ist. Typisch für Yersinien ist eine Infektion, die zuerst die Lymphknoten befällt. „Wir konnten nachweisen, dass der Wirt auf die frühe Infektion mit Yersinien mit einer massiven Einwanderung von Abwehrzellen, den sogenannten Neutrophilen, reagiert“, erklärt Dersch. Außerdem versuche der Wirt, mit der Produktion bestimmter Gerinnungsfaktoren den eindringenden Keim bei der Ausbreitung im Gewebe zu behindern und ihn zu immobilisieren. „Durch die Gerinnungsfaktoren kann der infizierte Wirt ein Netz aus Fibrinfasern um den Erreger bilden, einen sogenannten „Clot“ oder Gerinnungsklumpen. Diese Struktur ist gleichzeitig sehr wichtig für das Immunsystem, welches diesen Zellklumpen als fremd erkennt und beseitigen kann.“ ###more###
Bakterien injizieren starke Gifte
In der Studie konnten die Wissenschaftler außerdem zeigen, dass kleine regulatorische RNA-Moleküle bei der Infektion eine wichtige Rolle spielen. Dies ist eine wichtige Strategie der Bakterien, weil sie damit bestimmte Stoffwechselprozesse anpassen, um neue Nahrungsquellen schnell zu erschließen – sozusagen eine evolutionäre Anpassung der Bakterien an den Wirt. Denn sie konkurrieren unter anderem mit dem Wirt um bestimmte Metallionen wie Eisen, Mangan oder Zink. Sowohl die Bakterien als auch die Wirtszellen verfügen über spezielle eisenbindende Moleküle, mit denen sie sich gegenseitig das Eisen entziehen und so für das eigene Überleben sichern. „Trotz seiner starken Immunantwort kann der Wirt den Kampf gegen die bakterielle Infektion letztendlich nicht gewinnen“, sagt Petra Dersch. „Die Bakterien injizieren starke Gifte in die Wirtszellen, sogenannte Effektoren, die die Zellen töten.“
Spontanes Anschalten von Virulenzgenen
In einem weiterführenden Experiment untersuchten die HZI-Forscher gemeinsam mit Kollegen der Technischen Universität Braunschweig vom Braunschweiger Zentrum für Systembiologie (BRICS), der Universität Saarbrücken und der TU München die Yersinien-Infektion auch noch direkt auf der Ebene einzelner Bakterienzellen. Bei diesem systembiologischen Ansatz zeigte sich ebenfalls, dass die Darmbakterien sehr gut in der Lage sind, sich an das Umfeld im Lymphgewebe des Wirtes anzupassen. „Durch eine komplexe genetische Verschaltung werden in einigen Yersinia-Zellen bestimmte Virulenzgene spontan „angeschaltet“, in anderen aber nicht. Diese Verschiedenartigkeit kann das Überleben des Erregers im Wirt sichern, weil einige Bakterien beispielsweise an eine künftig neue Situation im Darm besser angepasst sind“, erklärt Aaron Nuss, Wissenschaftler im Team von Petra Dersch. „Bisher haben wir das gesamte Ausmaß der Verschiedenartigkeit in den Erregerpopulationen – und welche Vorteile sie für die Bakterien hat – noch nicht genau analysieren können. Wenn wir dies besser verstehen, könnten wir diese Pathogene auch besser bekämpfen.“
Transkriptionsprofile anderer Pathogene im Blick
„Die neuen Untersuchungsmöglichkeiten mit modernster Technologie erlauben uns wichtige Einblicke in das Zwiegespräch zwischen Pathogen und Wirt während einer Infektion in Geweben oder auch auf Basis der einzelnen Zelle“, sagt Petra Dersch. „In Zukunft werden wir auch Transkriptionsprofile anderer Pathogene erstellen können, um bisher verborgene Genfunktionen zu entdecken, die wesentlich für das Überleben in verschiedenen Wirten sind. Dies wird zudem die Identifikation von potenziellen Ansatzpunkten für Medikamente verbessern.“ (idw, red)
Literatur:Aaron M. Nuss, Michael Beckstette, Maria Pimenova et al.: Tissue dual RNA-seq: a fast discovery path for infection-specific functions and riboregulators shaping host-pathogen transcriptomes. PNAS, 2017, January 17; 114 (3), DOI: 10.1073/pnas.1613405114.
Aaron M. Nuss, Franziska Schuster, Louisa Roselius, Johannes Klein, René Bücker, Katharina Herbst, Ann Kathrin Heroven, Fabio Pisano, Christoph Wittmann, Richard Münch, Johannes Müller, Dieter Jahn and Petra Dersch: A precise 1 temperature-responsive bistable switch controlling Yersinia virulence. PLOS Pathogens, 2016, Dec 22;12(12), DOI: 10.1371/journal.ppat.1006091.