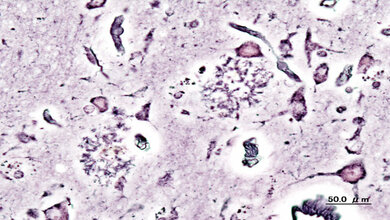
Sphingosin-1-phosphat (S1P) erfüllt als Signalmolekül zahlreiche Funktionen. Normalerweise fördert es in vielen Körperzellen die Zellteilung und das Wachstum. Kommt es jedoch vermehrt vor, scheint es vor allem in Nervenzellen ein Programm in Gang zu setzen, das zum Zelltod führt. „Da das Gehirn besonders reich an S1P-Vorläufern ist, kann es beim Versagen des Enzyms S1P-Lyase, welches Sphingosin-1-phosphat abbaut, besonders schnell in Nervenzellen zur verhängnisvollen Anhäufung dieses Moleküls kommen“, sagt die Korrespondenzautorin Privatdozentin Dr. Gerhild van Echten-Deckert vom Life & Medical Sciences Institute (LIMES) der Universität Bonn.
Drastische Veränderungen im Zellstoffwechsel beobachtet
Die fatale Wirkung des S1P-Fettmoleküls untersuchten die Wissenschaftler der Universität Bonn mit ihren Kollegen vom Deutschen Zentrum für Neurodegenerative Erkrankungen, Universitätsklinikum Jena, Karolinska Institut Stockholm (Schweden), der Universität San Francisco (USA) und von der Universität St. Petersburg (Russland) an Mäusen. Die Tiere verfügten in bestimmten Nervenzellen des Gehirns nicht über das Abbauenzym S1P-Lyase, weshalb sich dort das Sphingosin-1-phosphat krankhaft anreicherte. „Wir konnten zeigen, dass es bei Anhäufung von S1P im Gehirn zu mehreren drastischen Veränderungen im Zellstoffwechsel kommt, die vor allem die Kommunikation zwischen den Nervenzellen, die für Lernen und Gedächtnisbildung wichtig ist, erheblich beeinträchtigt“, berichtet Prof. Dr. Dieter Swandulla vom Institut für Physiologie II der Universität Bonn.
Chemische Synapsen bilden die Schaltstellen: Dort wird die elektrisch kodierte Information, die von einer Nervenzellen auf eine andere übertragen werden soll, in ein chemisches Signal übersetzt und nach der Übertragung wieder in ein elektrisches umgewandelt. Dieser Vorgang erlaubt es, dass Synapsen eine Art chemisches Gedächtnis entwickeln können, indem sie eine erregende oder hemmende Wirkung erzielen. Diese auf molekularer Ebene ablaufenden Prozesse sind die Grundlage für Lernen und Gedächtnis.
Anhäufung von S1P stört die Informationsübertragung im Gehirn
Die Wissenschaftler wiesen modellhaft an den Mäusen nach, dass bei einer Anhäufung von S1P vor allem in Nervenzellen des Hippocampus und des Kleinhirns für die Informationsübertragung wichtige Strukturen verändert sind. „Dies führt dazu, dass speziell eine Form der Kurzzeit-Gedächtnisbildung - die sogenannte synaptische Fazilitierung - deutlich vermindert ist“, sagt Prof. Swandulla.
Eine Analyse der molekularen Mechanismen ergab, dass durch die Anhäufung von S1P ein wichtiges zelluläres Regelsystem, das sogenannte Ubiquitin-Proteasom-System, in Mitleidenschaft gezogen wird. Es gewährleistet, dass die Gesamtheit der Zellproteine (Proteom) in gleichbleibender Qualität gebildet wird. „Wir konnten zeigen, dass die durch S1P bedingte Verminderung des Enzyms Ubiquitin-specific Protease 14 (USP14) als ein Teil dieses Systems im Wesentlichen ursächlich für die beobachteten Veränderungen der synaptischen Morphologie und Funktion in diesem Mausmodell ist“, sagt Dr. van Echten-Deckert.
Auslöse neurodegenerativer Erkrankungen?
Die Wissenschaftler nehmen an, dass die durch ein Überangebot von S1P hervorgerufenen Funktionsstörungen in der Signalübertragung des Gehirns möglicherweise auch zu neurodegenerativen Erkrankungen beitragen. Andererseits beobachteten Forscher auch eine Verminderung von S1P in frühen Phasen der Alzheimer-Erkrankung. Die Wissenschaftler wollen nun mit weiteren Studien klären, unter welchen Bedingungen S1P Fluch oder Segen für das Gehirn ist. (idw, red)
Daniel N. Mitroi, André U. Deutschmann, Maren Raucamp et al.: Sphingosine 1-phosphate lyase ablation disrupts presynaptic architecture and function via an ubiquitin-proteasome mediated mechanism. Scientific Reports 6, 2016, Article number: 37064, DOI: 10.1038/srep37064
Artikel teilen