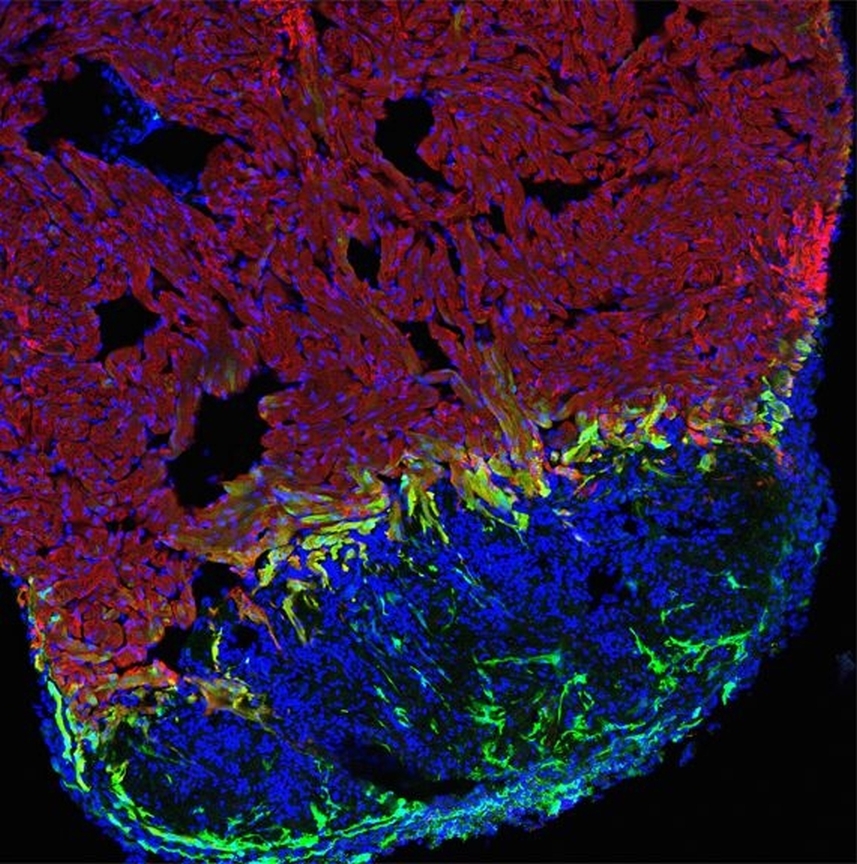
Sogar Verletzungen am Herzen heilen bei dieser Fischart vollständig wieder aus. Kardiologen, die Herzinfarktpatienten behandeln, können davon bisher nur träumen. Wissenschaftler der Universitäten Utrecht und Ulm haben nun einen zentralen molekularen Mechanismus entschlüsselt, über den dieser Heilungsprozess gesteuert wird.
„Das verletzte Gewebe regeneriert sich durch die vermehrte Zellteilung von Herzmuskelzellen an der Wundgrenze“, erklärt Professor Gilbert Weidinger vom Institut für Biochemie und molekulare Biologie der Universität Ulm. Wie das internationale Forscherteam – an dem neben dem Weidinger-Labor auch Wissenschaftler des Uni-Klinikums Utrecht beteiligt sind – zeigen konnte, wird die Zellvermehrung über ein besonderes Protein gesteuert: das sogenannte bone morphogenetic protein (BMP). BMP ist ein wichtiges Signalprotein der Zell-Zell-Kommunikation. Die Forscher konnten nachweisen, dass es insbesondere im Wundbereich reaktiviert wird, wo gesundes und verletztes Gewebe aufeinander stoßen.
Aktivität von Genen lokalisieren
Hierfür haben die Molekularbiologen ein spezielles Verfahren (Tomo Seq) zur Sequenzierung von RNA (RiboNucleic Acid) entwickelt, über das es möglich ist, im Wundbereich und den benachbarten Gewebsregionen die Aktivität diverser Gene genau zu lokalisieren. „So entsteht ein genomweiter Atlas an regional sehr unterschiedlichen Expressions- und Aktivitätsmustern, die im regenerierenden Herzen Aufschluss darüber geben, welche Gene und Zell-Signale im gesunden und im verletzten Gewebe, beziehungsweise genau an der Wundgrenze aktiviert sind“, so Chi-Chung Wu. Der Doktorand aus Hong Kong, der an der Uni Ulm forscht, ist wie sein Utrechter Kollege Fabian Kruse Co-Erstautor der veröffentlichten Studie.
So wiesen die Wissenschaftler nach, dass das BMP-Signal von Herzmuskelzellen aktiviert wird, die aus dem Grenzbereich zwischen gesundem und verletztem Herzmuskelgewebe kommen. Mit Hilfe von transgenen Zebrafischlinien, bei denen der BMP-Signal-Weg einerseits blockiert und andererseits verstärkt wurde, konnten die Forscher den Regenerationsprozess gezielt beeinflussen. Bei der genetisch veränderten Variante mit blockiertem BMP-Signal-Weg waren Zellvermehrung und damit die Regenerationsfähigkeit deutlich reduziert. Bei der Variante mit überaktivem BMP konnte die Regeneration dagegen sogar forciert werden.
BMP-Signal kann auch zu Zell-Selbstmord führen
„Erstaunlicherweise spielt dieser Signalweg keine Rolle bei der Zellteilung während der embryonalen Herzentwicklung, sondern nur bei verletzungsbedingter Herzregeneration“, zeigen sich die Wissenschaftler überrascht. Das heißt, dass die Gewebebildung im Fischherz bei der Embryonalentwicklung und bei der Regeneration über unterschiedliche Prozesse gesteuert wird.
Und auch ein weiterer Befund lässt die Forscher staunen: „Das BMP-Signal ist auch in verletzten Maus-Herzen aktiv, aber dort reagieren die Herzzellen völlig anders darauf: sie sterben. Hier wird durch BMP also keine Regeneration ausgelöst, sondern die beschädigten Zellen werden stattdessen in den `Selbstmord´ getrieben“, so Professor Jeroen Bakkers vom niederländischen Hubrecht Institut am Universitätsklinikum Utrecht, der wie Professor Gilbert Weidinger ko-korrespondierender Autor der Studie ist.
Die Wissenschaftler wollen nun herausfinden, wieso Herzzellen in Zebrafischen und in Säugetieren wie der Maus so unterschiedlich reagieren und welche Prozesse letztendlich dafür verantwortlich sind. Könnten Säugetiere – denen taxonomisch auch der Mensch zuzurechnen ist – verletzte Herzzellen ebenso gut durch gesunde ersetzen wie der Zebrafisch, gäbe es neue Hoffnung für Herzinfarktpatienten.
Denn ein Myokardinfarkt ist deshalb so gefährlich für den Menschen, weil sterbende Herzmuskelzellen nicht ersetzt werden können, sodass der Herzmuskel vernarbt und das Organ an Kraft verliert. Die medizinische Relevanz des Projektes ist also beträchtlich. „Vielleicht wird es eines Tages möglich sein, die Regenerationsfähigkeit von menschlichem Herzgewebe durch entsprechende Medikamente oder Therapien, die auf der Grundlage solcher Forschungsergebnisse entwickelt wurden, deutlich zu verbessern“, hoffen die Forscher. (idw, red)
* gesundes Muskelgewebe rot, Wunde blau und aktivierte Herzmuskelzellen grün angefärbt
Chi-Chung Wu, Fabian Kruse, Mohankrishna Dalvoy Vasudevarao et al.: Spatially Resolved Genome-wide Transcriptional Profiling Identifies BMP Signaling as Essential Regulator of Zebrafish Cardiomyocyte Regeneration. Dev Cell 2016, 36: 36–49. dx.doi.org/10.1016/j.devcel.2015.12.010
Artikel teilen