Brustkrebs: Metallopeptid zerstört Mitochondrienfunktion
Die Studie zu diesem kupferhaltigen Peptid macht deutlich, welch großes Wirkpotenzial solche Metallopeptide haben. Mitochondrien sind die Kraftwerke der Zelle und zudem Knotenpunkt des programmierten Zelltods. Sind die Mitochondrien aus dem Spiel, ist eine Zelle nicht mehr lebensfähig. Sie vernichtet sich selbst durch Apoptose. Krebszellen enthalten mit ihrem erhöhten Stoffwechsel nicht nur mehr Mitochondrien als gesunde Zellen, sondern diese unterscheiden sich auch strukturell und funktionell von den Organellen in nicht transformierten Zellen. Maligne Mitochodrien gelten daher als hervorragender Ansatzpunkt für neue Wirkstoffe gegen Krebs. Die Forschungsgruppe um den Bioanorganiker Kogularamanan Suntharalingam am King’s College in London (Großbritannien), erforscht, inwieweit es möglich ist, in die Organellen spezifische Mitochondriengifte einzuschleusen, und welchen Schaden diese dort anrichten.
ROS können Mitochondrien zerstören
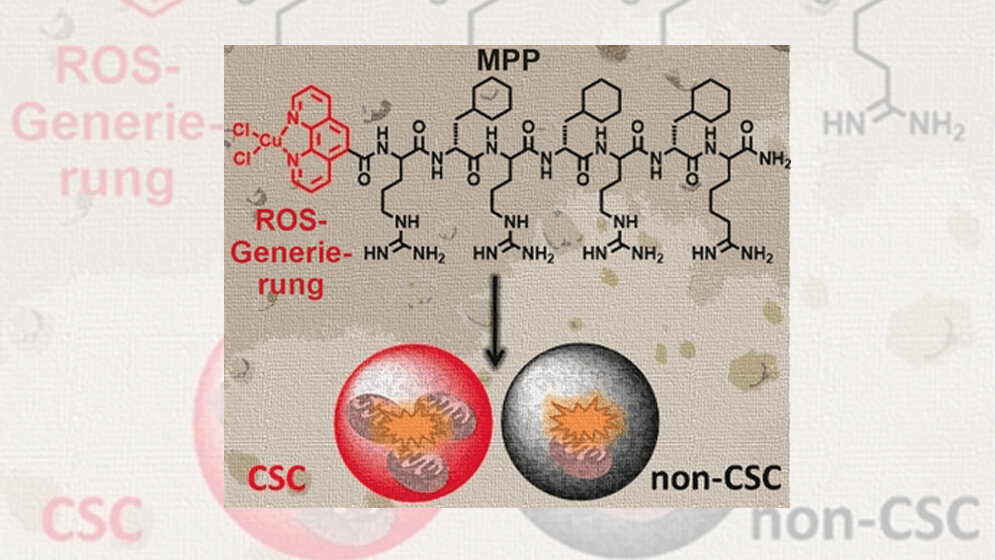
Bestimmte Wirkstoffe wie etwa solche, die reaktive Sauerstoffspezies (ROS) freisetzen oder generieren, können letztlich zur Vernichtung des Mitochodriums führen. Die ROS wirken insbesondere im mitochondriellen Stoffwechsel. Wird dieser ausgeschaltet, kann das Organell nicht mehr arbeiten. Wie Suntharalingam und seine Kollegen unlängst entdeckten, ist das metallorganische Reagenz Kupfer(II)-phenanthrolin ein starker ROS-Erzeuger mit besonderem Wirkpotenzial gegen die gefährlichen Krebsstammzellen. Dieses Präparat muss jedoch an seiner Adresse ankommen und die äußere Mitochondrienmembran passieren. Eine Lösung wäre ein „Paket” in Form einer Ankopplung an membranlösliche Peptide: „Angeheftet an sogenannte Mitochondrien-penetrierende Peptide ist ebenfalls eine selektive und effiziente Ablieferung in den Mitochondrien möglich”, schreiben die Autoren.
Ergebnisse waren beeindruckend
In Zusammenarbeit mit den Peptidchemikern der Forschungsgruppe von Nicola O’Reilly am Francis-Crick-Institut stellten die Wissenschaftler das tödliche Metallopeptid-Paket her, indem sie den Phenanthrolin-Kupfer(II)-komplex mit einem bekannten Mitochondrien-penetrierenden Peptid kovalent verknüpften. Die Aktivitätstests wurden an zwei Brustkrebs-Zelllinien vorgenommen, an der eigentlichen Krebszelllinie und an einer Zelllinie, die mit Krebsstammzellen angereichert war. Die Krebsstammzellen bilden das „Herz“ des entarteten Gewebes und entgehen häufig konventionellen Therapien. Die Ergebnisse waren beeindruckend: Die Autoren beobachteten einen dosisabhängigen Zellverlust von bis zu hundert Prozent, Auflösung der Mitochondrienmembran, Wirkstoffeintrag in die Mitochondrien, ROS-Erzeugung und eine erhebliche Beeinträchtigung des mitochondriellen Stoffwechsels. Die Krebsstammzellen waren zudem stärker betroffen als die normalen Zellen, was mit ihrem noch höheren Gehalt an Mitochondrien erklärt wurde.
Um einen Tumor endgültig auszulöschen, muss sein Herz aus dem Spiel genommen werden. Die Studie macht deutlich, welch großes Wirkpotenzial die Metallopeptide als zielgerichtete Waffen haben, insbesondere gegen Krebsstammzellen. (idw, red)
Laws, K., Bineva-Todd, G., Eskandari, A., Lu, C., O'Reilly, N. and Suntharalingam, K. (2017): A Copper(II) Phenanthroline Metallopeptide That Targets and Disrupts Mitochondrial Function in Breast Cancer Stem Cells. Angew. Chem., DOI:10.1002/ange.201710910.
Artikel teilen